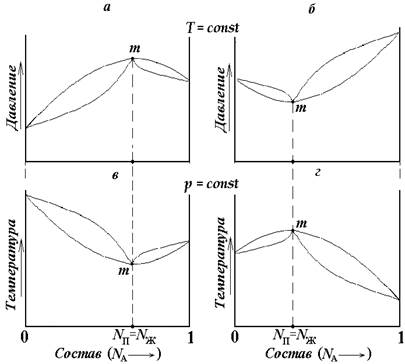
 В
случае больших отклонений от свойств идеального раствора линии жидкости и пара,
изображаемые на диаграммах состояния, соприкасаются с образованием минимума или
максимума (точек экстремума m) как
это схематично показано на рисунках 5.6 (а, б, в, г).
В
случае больших отклонений от свойств идеального раствора линии жидкости и пара,
изображаемые на диаграммах состояния, соприкасаются с образованием минимума или
максимума (точек экстремума m) как
это схематично показано на рисунках 5.6 (а, б, в, г).
Рис. 5.6. Диаграммы состояния: а и б – состав - давление насыщенного пара; в и г – состав – температура кипения для двойных жидких систем с экстремумами.
В точках экстремума, называемых азеотропными, составы жидкости и пара выравниваются, т.е.: Nп= Nж как по веществу А, так и по веществу В.
Изобарные диаграммы состав – давление насыщенного пара, как видно из рис. 5.6, внешне похожи на обратные диаграммы состав – температура. Это объясняется обратно пропорциональной зависимостью между температурой кипения и давлением пара, поскольку жидкость закипает при более высокой температуре, чем меньше давление ее паров.
Соотношения между относительными концентрациями вещества в жидкости и паре на качественном уровне исследовал Д.П. Коновалов (1881). Он установил два закона, а именно:
Первый закон.
В общем случае относительное содержание данного компонента в паре отличается от относительного содержания этого компонента в равновесном с ним жидком растворе.
В паре содержится больше того компонента, добавление которого в раствор повышает общее давление насыщенного пара (или понижает температуру кипения раствора).
Пар обогащается более летучим компонентом.
Известны и другие формулировки этого закона. Среди них такие:
"Насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает полное давление пара" [18].
При постоянном давлении температура кипения раствора возрастает при увеличении концентрации компонента, содержание которого в паре меньше, чем в растворе.
При постоянной температуре давление пара над раствором, возрастает при увеличении концентрации компонента, содержание которого в паре больше, чем в растворе.
Второй закон Д.П. Коновалова. Относится к реальным растворам - азеотропным смесям.
Экстремумы на кривых общего давления пара (температур кипения) – состав соответствуют такому равновесию раствора и его насыщенного пара, при котором составы обеих фаз одинаковы.
Если взять жидкий азеотроп (точка m) и понижать давление над ним, то в точке m начнет образовываться пар и будет наблюдаться кипение при постоянной температуре.
В соответствии со вторым законом Коновалова пар и жидкость в этой точке будут иметь одинаковый состав. По этой же причине данная двухфазная система ведет себя как однофазная и является инвариантной.
В отличие от других смесей азеотропная смесь переходит в пар без изменения состава и при постоянном давлении.
Для расчетов тепловых эффектов сопровождающих фазовые переходы обычно используют уравнение Клаузиуса- Клайперона (5.12).
ВОПРОСЫ
1. Приведите условия интегрирования уравнения Клаузиуса-Клайперона. Какие величины можно вычислить с помощью этого уравнения?
2. Выполните анализ диаграммы фазового состояния воды. Какими особенностями характеризуются тройная и критическая точки, кривые на этой диаграмме?
3. Что такое экстракция? Сформулируйте закон распределения вещества и приведите вывод этого закона на основе понятий термодинамики.
4. Приведите анализ фазовой диаграммы двухкомпонентной системы, в которой имеет место химическое взаимодействие между веществами. Чем характеризуется эвтектика и каковы особенности ее образования?
5. Приведите анализ фазовой диаграммы двухкомпонентной системы, в которой отсутствует химическое взаимодействие между веществами. Чем характеризуется эвтектика и каковы особенности ее образования?
6. В чем состоят особенности перегонки азеотропных смесей с водяным паром?
7. Каким образом можно определить энтальпию кристаллизации при понижении температуры? Поясните расчетные формулы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.