Tuesday, November 06, 2007
ГЛАВА 5
ТЕРМОДИНАМИКА МЕЖФАЗНЫХ
ПЕРЕХОДОВ И РАВНОВЕСИЙ
«Понятие о фазах и компонентах, оказавшиеся в высшей степени плодотворными ...внесли простоту и единство в сложную область химических превращений, создали возможность рациональной классификации и наглядного графического изображения»
[7]
5.1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ
Фазой в термодинамике называется часть термодинамической системы, обладающая одинаковыми физическими и химическими свойствами и ограниченная от другой части системы (фазы) поверхностью раздела. Понятие фазы, как и понятие термодинамической системы, относится к объектам достаточно большого объема. При этом предполагается, что специфические свойства молекул, атомов, ионов, расположенных на поверхности раздела, не сказываются на свойствах всей системы в целом. Принимается также, что вещества отличающиеся разным строением, но имеющие одинаковый элементный состав образуют разные фазы. Примером может служить смесь из карбона, графита и алмаза. Названные вещества образованы углародом, но имеют разное строение. Поэтому для такой смеси следует принять наличие трех фаз. Жидкие и твердые фазы называются конденсированными.
Следует отметить, что природные системы являются гетерофазными, поскольку идеально чистых веществ, лишенных примесей иного агрегатного состава в природе не существует. Даже газы, образующие атмосферу Земли, содержат мельчайшие частички жидкости или твердого тела и только в результате трудоемкой искусственной очистки удается получить системы с достаточной степенью приближения к негетерофазным (монофазным) системам.
Вещества, находящиеся в различных агрегатных состояниях или кристаллических модификациях, способны самопроизвольно при некоторых условиях существования переходить из одной фазы в другую (фазовые переходы). Примерами фазовых переходов являются: испарение, конденсация, кристаллизация, переход вещества из одной кристаллической модификации в другую. Фазовые переходы продолжаются до установления динамического равновесия между веществами, находящимися в различных фазах,
Фазовые равновесия – термодинамические равновесия в многофазных гетерогенных системах, характеризуемые обратимыми переходами вещества из одной фазы в другую. Эти равновесия принято описывать с помощью правила фаз Гиббса и понятий компоненты, число степеней свободы
Компоненты – составляющие многофазную систему вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы. Понятие компоненты тождественно понятию вещество - составная часть системы. Однако существует и различие между этими понятиями. Оно выявляется при оценке числа компонентов.
Число компонентов (k) оценивается с учетом числа уравнений, связывающих составляющие вещества. Возможны два случая.
1. Вещества- составные части системы не взаимодействуют между собой. Тогда число компонентов точно совпадает с числом образующих систему веществ.
Пример. В смеси инертных газов, которые между собой не взаимодействуют число видов газа и компонентов совпадает.
2. Составные части системы взаимодействуют между собой. Число компонентов равно числу этих веществ минус число уравнений описывающих реакции между ними.
Пример. Имеется реакционная система, представленная уравнением:
3Н2 + N2 = 2 NH3 . В этой смеси 3 вещества. Но они взаимодействуют между собой. Это взаимодействие показано уравнением реакции. Поэтому число компонентов равно 2.
Под числом степеней свободы или вариантностью(v)* системы понимают наибольшее число внешних и внутренних факторов, влияющих на состояние системы, которые можно менять в определенных пределах без изменения числа или вида фаз. Внешними факторами фазового равновесия считают температуру и давление, а внутренними – концентрации компонентов.
Число степеней свободы можно определить как разность между общим числом переменных, описывающих многофазную равновесную систему и числом уравнений связывающих эти переменные.
В частности оценку числа степеней свободы для системы представленной газами: Н2, N2, NH3 можно выполнить следующим образом. Общее число переменных для этой системы равно 4. Оно складывается из числа компонентов, равного 2 и внешних факторов – температуры и давления.
Компоненты этой системы связаны равенством 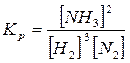 .
.
Поэтому v= 4- 1= 3
Таким образом, наименьшее число компонентов, которые представляют состав фаз, а также температура и давление определяют число независимых факторов равновесия (число степеней свободы), под влиянием которых находится данная система.
Правило фаз Гиббса.
Правило фаз Гиббса устанавливает взаимосвязь между числом степеней свободы многофазной системы, числом компонентов этой системы и числом фаз. В основе вывода соотношения, представляющего правило фаз Гиббса лежит следующее алгебраическое утверждение:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.