Жидкость « пар (5.4)
Конденсация
Оценить влияние температуры на эти процессы можно, сопоставляя формулу распределения Больцмана (3.12) NA = Nобщ ×e–E/RT. и основную формулу кинетической теории газов, которая имеет вид:
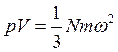 (5.5)
(5.5)
где p– давление насыщенного пара; V –объем пара; N – число молекул; m - масса молекулы; w - средняя квадратичная скорость молекул.
Учитывая, что количество молекул, обладающих повышенной (относительно заданного предела, определенного значением w) энергией нетрудно заключить, что поскольку число активных молекул с повышением температуры возрастает, то и скорость испарения увеличивается с повышением температуры.
Вместе с тем, как следует из экспериментов и доказывается в кинетической теории газов, скорость конденсации оказывается значительно меньше скорости испарения. Поэтому именно испарение определяет давление насыщенного пара над жидкостью, а значит и зависимость давления пара от температуры, что делает основным показателем способности любой жидкости к испарению. Вместе с тем давление насыщенного пара при заданной температуре является одной из важнейших специфических характеристик химических соединений, которые приводятся в справочниках
Давление насыщенного пара
над чистой (идеальной) жидкостью
Качественная оценка
Следует также иметь в виду, что справочные данные, часто относят к системе жидкость в контакте с ее паром. Чтобы перейти к системе жидкость в контакте с воздухом необходимо вводить поправки, обычно имеющиеся в комментариях к таблицам. Поправки, могут оказаться существенными. При более высоких температурах, как видно из табл. 5.2, значимость поправки возрастает.
Таблица 5.2
Давление пара воды в контакте с водой и атмосферным воздухом
|
t ° C |
Поправка = ( р0,775/100) |
Давление насыщенного пара, р мм рт. ст. |
|
|
контакт с водой |
контакт с воздухом |
||
|
-10 |
0,017 |
2,149 |
2,166 |
|
0 |
0,035 |
4,579 |
4,614 |
|
25 |
0,184 |
23,756 |
23,940 |
|
44 |
0,529 |
68,26 |
68,789 |
Количественная оценка
Зависимость давления насыщенного пара от температуры выражается уравнением Клапейрона – Клаузиуса, термодинамический вывод которого приведен ниже.
Пусть испаряется 1 моль воды. Обозначим водную фазу через a, а газообразную (пар) - через b.
Для каждой фазы при постоянном давлении можно записать:
![]() (5.6)
(5.6)
![]() (5.6 а)
(5.6 а)
При равновесии ![]() . С учетом этого равенства
получим:
. С учетом этого равенства
получим:
![]() ;
(5.7)
;
(5.7)
Откуда ![]() (5.8)
(5.8)
Из второго закона термодинамики следует, что энтропия и и энтальпия фазового перехода связаны между собой следующим равенством:
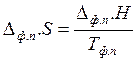 (5.9)
(5.9)
Решим уравнение (5.8) относительно dp / dT и подставим в полученное выражение величину DфпSиз уравнения (5.9). В конечном итоге получим:
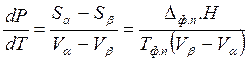 (5.10)
(5.10)
С учетом того, что при испарении ![]() <<
<<![]() можно получить, что:
можно получить, что:
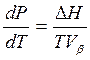 (5.11)
(5.11)
Предположим, что пар – идеальный газ, тогда 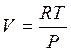 .
.
Подставив это выражение в формулу (5.11) получим уравнение Клапейрона - Клаузиуса в дифференциальной форме:
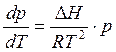 (5.12)
(5.12)
Разделим переменные и проинтегрируем полученное выражение
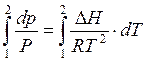 ; (5.13)
; (5.13)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.