Эта диаграмма показывает, как меняется состав двухкомпонентной системы в зависимости от температуры. На диаграмме четко показаны области, соответствующие конкретным фазовым составам системы. Например, область показанная точками ТА t’Е – область, где одновременно присутствуют твердые вещества А и расплав из веществ А и В. В области ниже линии солидуса (ТАЕТВ) образуется эвтектика, смесь крупных кристаллов веществ А и В на фоне более мелких кристалликов этих же веществ. В области обозначенной точками Et11ТВ находятся твердые вещества В и расплав из веществ А и В.
Эвтектическая точка Е соответствует равновесию между жидким раствором (расплавом) и двумя кристаллическими фазами. Такое равновесие называется эвтектическим.
В точке М: υ=2-1+1=2
В точке М1: υ=2-2+1=1
В точке М11: υ=2-3+1=0
Принцип непрерывности.
При непрерывном изменении параметров, определяющих состояние системы (давления, температуры, концентрации) свойства отдельных фаз системы изменяются также непрерывно. Свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или характер фаз.
Таким образом, принцип непрерывности свойств системы сохраняется до тех пор, пока не изменится число или характер образующих систему фаз. При появлении новых или исчезновении имеющихся фаз свойства системы в целом меняются скачкообразно. Примерами скачкообразных изменений свойств системы могут служить изломы на кривых охлаждения или нагревания при термическом анализе (см. раздел "термический анализ" и рис. 5. 3)
Термический анализ
Метод термического анализа был разработан Н.С. Курнаковым. Он широко применяется для определения температур фазовых переходов и получения термических характеристик эндо- и экзотермических процессов.
Наибольший интерес представляют методики термического анализа основанные на изучении кривых нагревания и охлаждения. Простейший вариант методики измерения кривых нагревания выполняют с использованием компактной трубчатой электропечи. Внутрь печи помещают небольшую кювету с пробой и термопарой [2]. Печь через реостат подключают к источнику энергии, а термопару к электронному самописцу. С помощью реостата регулируют силу тока в печи таким образом, чтобы в отсутствие пробы температура в печи поднималась плавно, без резких скачков как показано на рис. 5.3 (прерывистая кривая –термограмма фона*).
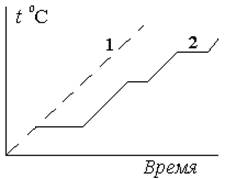
Рис. 5.3. Общий вид термограммы:
1) фона; 2) пробы.
При нагревании образца пробы на термограмме 2 появляются участки, соответствующие температурам фазовых переходов. Например, плавлению или испарению. Сравнивая эти термограммы с термограммами для чистых веществ, получают информацию о составе пробы. Расшифровка термограммы пробы значительно облегчается, если ее сравнивают с известной термограммой стандартного образца. Термограммы стандартных образцов, как правило, приводят в соответствующих атласах.
Результаты термического анализа обычно используют для составления фазовых диаграмм многокомпонентных систем
5.3. ХАРАКТЕРИСТИКА ВАЖНЕЙШИХ ПРОЦЕССОВ
Среди важнейших процессов межфазовых переходов, как видно из табл. 5.1, можно выделить процессы испарение и конденсацию, плавление и кристаллизацию.
5.3.1. ИСПАРЕНИЕ и КОНДЕНСАЦИЯ
На поверхности любой жидкости одновременно происходит два процесса испарение жидкости и конденсация ее паров. Испарение вызывает тепловое движение молекул жидкости. Если кинетическая энергия каких-либо поверхностных молекул оказывается больше энергии связи между этими молекулами и другими молекулами жидкости, связи разрываются и молекулы переходят в газовую фазу. Часть испарившихся молекул конденсируется и присоединяется к жидкости вновь. В закрытом пространстве скорости этих процессов выравниваются, и достигается динамическое равновесие вида:
Испарение
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.