Растворение протекает самопроизвольно. Это с термодинамической точки зрения, в частности означает, что при заданных значениях температуры и давления DG<0. Исключение составляют термодинамически неустойчивые пересыщенные растворы. С учетом названной терминологии для процесса смешивания[3] можно записать:
DGсмеш = DHсмеш -T DSсмеш(5.19)
Из уравнения (5.19) следует, что изменение энергии Гиббса в процессе образования раствор может быть обусловлено как энтальпийным, так и энтропийным факторами. Знак DHсмеш и DSсмеш зависит от природы смешиваемых веществ, но в любом случае поскольку растворение происходит самопроизвольно, изменение энергии Гиббса должно быть отрицательным, т.е. DGсмеш< 0.
• Если при растворении рвутся связи в молекулах этих веществ, что требует затрат энергии из вне DHсмеш> 0 процесс оказывается эндотермическим. В результате разрыва связей увеличивается мера неупорядоченности системы, поэтому DSсмеш> 0.
• Если при образовании раствора возникают новые связи между отдельными компонентами, процесс оказывается экзотермическим DHсмеш< 0. Образование новых связей приводит к большему упорядочиванию системы, а значит к уменьшению энтропии DSсмеш< 0.
На рис. 5.4 представлены зависимости общего давления насыщенного пара от состава раствора. Между тем, для реальных растворов более информативными представляются диаграммы[4], построенные совмещением экспериментальных кривых, которые характеризуют зависимости общего давления насыщенного пара, как от состава раствора, так и от состава пара при постоянной температуре. Часто полезными оказываются фазовые диаграммы, отражающие температурную зависимость состава бинарной смеси при постоянном давлении. Общий вид таких диаграмм для неограниченно смешивающихся жидкостей А и В представлен на рис. 5.5.
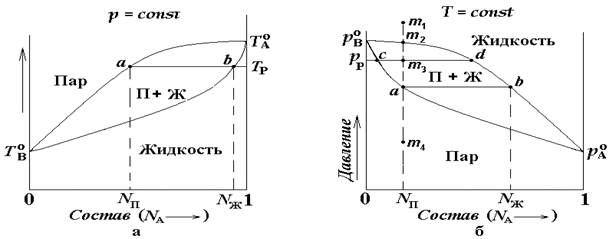
Рис. 5.5 Диаграммы температура – состав (а) и давление насыщенного пара (П) - состав (б) для бинарной смеси летучих жидкостей (Ж) А и В.
На
представленных на рис.5.4 диаграммах ![]() -
температуры кипения чистых жидкостей А, В и раствора соответственно;
-
температуры кипения чистых жидкостей А, В и раствора соответственно; ![]() и рр- давление
насыщенного пара над чистыми жидкостями А, В и раствором соответственно; Nп и Nж – молярные доли компонента А соответственно в паре и в жидкости. Линии
и рр- давление
насыщенного пара над чистыми жидкостями А, В и раствором соответственно; Nп и Nж – молярные доли компонента А соответственно в паре и в жидкости. Линии ![]() и
и ![]() называются
линиями пара, а линии
называются
линиями пара, а линии ![]() и
и ![]() -
линиями жидкости. Между линиями жидкости и пара находится система, в которой
одновременно сосуществуют жидкость и пар, Вне этой области находятся
соответственно обозначениям на рисунке либо чистый пар, либо только жидкость.
-
линиями жидкости. Между линиями жидкости и пара находится система, в которой
одновременно сосуществуют жидкость и пар, Вне этой области находятся
соответственно обозначениям на рисунке либо чистый пар, либо только жидкость.
Анализ диаграммы позволяет проследить, как меняется фазовый состав равновесной системы по мере изменения заданных параметров (концентрации, давления, температуры). Рассмотрим, например, характер изменения фазового состава при различных давлениях. Для этого будем уменьшать давление, проходя через отметки m1, m2, m3, а и m4, показанные на рис 5.5 б. Система остается жидкой до тех пор, пока давление не уменьшится до значения соответствующего точке m2. В этой точке появляется пар, а ниже находится область, ограниченная линиями жидкости и пара, где одновременно сосуществуют жидкость и пар. В точке а состав пара отвечает значениям Nп по веществу А и (1 - Nп) по веществу В. Состав жидкости в этой точке соответствует точке b, расположенной на линии жидкости. Поэтому жидкость содержит Nж молей вещества А и (1- Nж) молей вещества В. При дальнейшем понижении давления состав жидкости меняется соответственно кривой жидкости, а состав пара - соответственно кривой пара. В области ниже кривой пара, например в точке m4 , присутствует только пар.
Относительное количество пара и жидкости при некотором давлении для известного общего состава можно оценить с помощью правила рычага. Например, для давления рр (см. рис. 5.5б) согласно правилу рычага имеем:
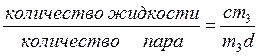 (5.20)
(5.20)
Азеотропы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.