Принцип соответствия.
Каждой совокупности фаз, находящихся в равновесии в данной системе, соответствует определенный геометрический образ на диаграмме состояния.
Под геометрическим образом понимают отдельные точки, кривые и даже области на диаграмме состояния ограниченные этими кривыми. Принцип соответствия можно продемонстрировать на примере геометрических образов, показанных на диаграмме состояния воды при невысоких давлениях (см. рис. 5.1.) и диаграмме состояния системы из двух взаимнонерастворимых неизоморфных веществ (рис.5.2).
Диаграмма состояния воды является примером диаграммы состояния однокомпонентной системы, отдельные фазы которых образованы одним и тем же веществом, находящимся в различных агрегатных состояниях. По координатным осям отложены переменные параметры - температура и давление. Области диаграммы, ограниченные кривыми, соответствуют условиям (температура и давление), при которых устойчиво то или иное агрегатное состояние.
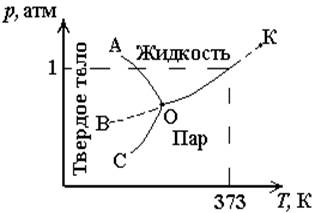 Рис.
5.1. Диаграмма состояния воды
Рис.
5.1. Диаграмма состояния воды
Точки "О" и "К" являются характерными. О – тройная точка с координатами р = 6,09×102 Па и Т = 273,16 К;. В этой точке одновременно сосуществуют, находясь в равновесии газ, жидкость и лед. Оценка числа степеней свободы для этой точки по уравнению (5.2) дает результат n=1-3+2=0, т.е. при указанных условиях система безвариантна и любое смещение от этих условий изменит равновесие. К – критическая точка. В этой точке исчезает равновесие между жидкостью и паром; n=1-2+2=1. Названия отдельных линий - геометрических образов и их соответствие фазам и конкретным процессам приведены в табл. 5.1.
Таблица5.1.
Соответствие линий (геометрических образов) процессам показанным на диаграмме состояния воды на рис. 5.1.
|
Температура повышается |
Температура понижается |
|||||
|
Линия |
АО |
ОК |
СО |
КО |
ОС |
ОА |
|
Процесс |
плавление (Т®Ж) |
испарение (Ж®П) |
сублимация (возгонка) (Т®П) |
конденсация (П®Ж) |
десублимация (П®Т) |
кристаллизация (Ж®Т) |
Любая точка, лежащая в области, ограниченной линиями АО и ОК соответствует жидкому состоянию волы, при котором две фазы находятся в равновесии. Так, при температурах и давлениях, отвечающих точкам на линии ОК, в равновесии находятся жидкая вода и пар. Линия ОК называется кривой испарения. Она выражает зависимость давления насыщенного водяного пара от температуры. В частности, при температуре 100°С давление насыщенного пара равно 101325 Па (1 атм). Это и есть точка кипения воды при атмосферном давлении. Линия АО называется кривой плавления. Она определяет равновесие между жидким и твердым состояниями воды.
Точки на линии сублимации СО отвечают условиям, при которых в равновесии находятся лед и водяной пар.
Расчет числа степеней свободы для любых точек находящихся на линиях диаграммы, а также точки К дает величину n = 1- 2 + 2 = 1. Это означает, что, двигаясь по указанным линиям можно изменять, не нарушая равновесие, только один параметр.
На рис. 5.2 приведена диаграмма состояния двухкомпонентной системы, состоящей из веществ А и В, которые не растворимы друг в друге и не взаимодействуют между собой.
|
ТАЕТВ – ликвидус, линия жидкости
t1Et11 – солидус, линия твердого тела
Е – эвтектическая точка
ТА – температура кипения твердого вещества А
ТВ – температура кипения твердого вещества В
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.