В конечном итоге имеем интегральную форму уравнения Клапейрона-Клаузиуса:
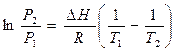 (5.14)
(5.14)
Зависимость давления насыщенного пара
от концентрации растворенных веществ
Давление насыщенного пара при данной температуре всегда постоянно, но оно снижается, если в жидкости растворить другое вещество. Это объясняется взаимодействием между молекулами растворенного вещества и растворителя. В результате взаимодействия уменьшается концентрация свободных молекул растворителя, как на поверхности, так и в объеме раствора, что приводит к уменьшению испарения, а значит и давлению пара над раствором.
Для таких систем, находящихся при постоянной температуре, выполняется соотношение, известное в литературе как закон Рауля?:
pi = pioNiж (5.15)
При постоянной температуре равновесное парциальное давление насыщенного[*] пара (pi) любого из компонентов раствора неэлектролита равно произведению давления пара этого компонента в чистом виде (piо) на его мольную долю в жидкой фазе (Niж).
Соотношение (5.15) для растворителя (s) можно записать следующим образом:
ps = psoNsж = pso (1- Niж ) (5.16)
Отсюда следует, что: 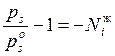 , а также
, а также
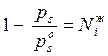 (5.17)
(5.17)
Соотношение (5.17) часто записывают в виде формулы, установленной Раулем эмпирическим путем в 1887 году:
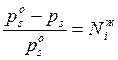 (5.18)
(5.18)
При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором равно мольной доле растворенного вещества.
Давление насыщенного пара
над неидеальным раствором
По мере концентрирования раствора вследствие химических (ассоциация, сольватация, диссоциация) и физических эффектов возникают существенные отклонения от зависимости, представляющей закон Рауля. В общем случае можно говорить лишь о некотором приближении свойств реальных растворов к свойствам идеальных растворов, устанавливая экспериментально предел концентраций, при которых поведение раствора подчиняется законам идеальных растворов.
Известны два случая отклонений от зависимости Рауля. Графики для этих случаев, соответствующих положительным (рис. 5.1а) и отрицательным отклонениям ( рис. 5.1б) показаны ниже.
Подобные зависимости часто используют при исследовании фазовых равновесий. Особенно они удобны для представления двухкомпонентных систем из веществ А и В, концентрации которых можно выразить в мольных долях. В этом случае мольные доли связаны соотношением NA = 1 - NB. С учетом того, что значение мольной доли меняется от 0 до 1, координата, определяющая общий состав* имеет конечное протяжение, и ее можно использовать для считывания концентрации любого из компонентов.
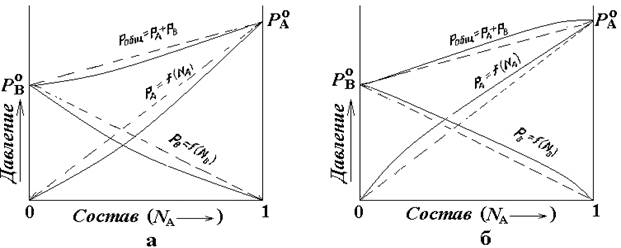
Рис. 5.4 Зависимость парциальных и полного давлений от общего состава раствора. Штрихом показаны зависимости для идеального раствора. Сплошной линией - для неидеального раствора.
Точки РА° и РВ° отвечают давлениям насыщенного пара над чистыми компонентами А, и В соответственно. Линии РА= f(NA) и РВ = f(NВ) указывают парциальное давление насыщенного пара компонентов А и В соответственно в зависимости от составадвухкомпонентной системы. Полное давление насыщенного пара, равное, согласно закону Дальтона (1.2), сумме парциальных давлений, показано линиями Робщ = РАРВ.
По отклонению свойств растворов от законов идеальных растворов можно судить о силе взаимодействия между молекулами образующими раствор. Взаимодействия, как следует из приведенного ниже анализа, существенно отличаются своими характеристиками.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.