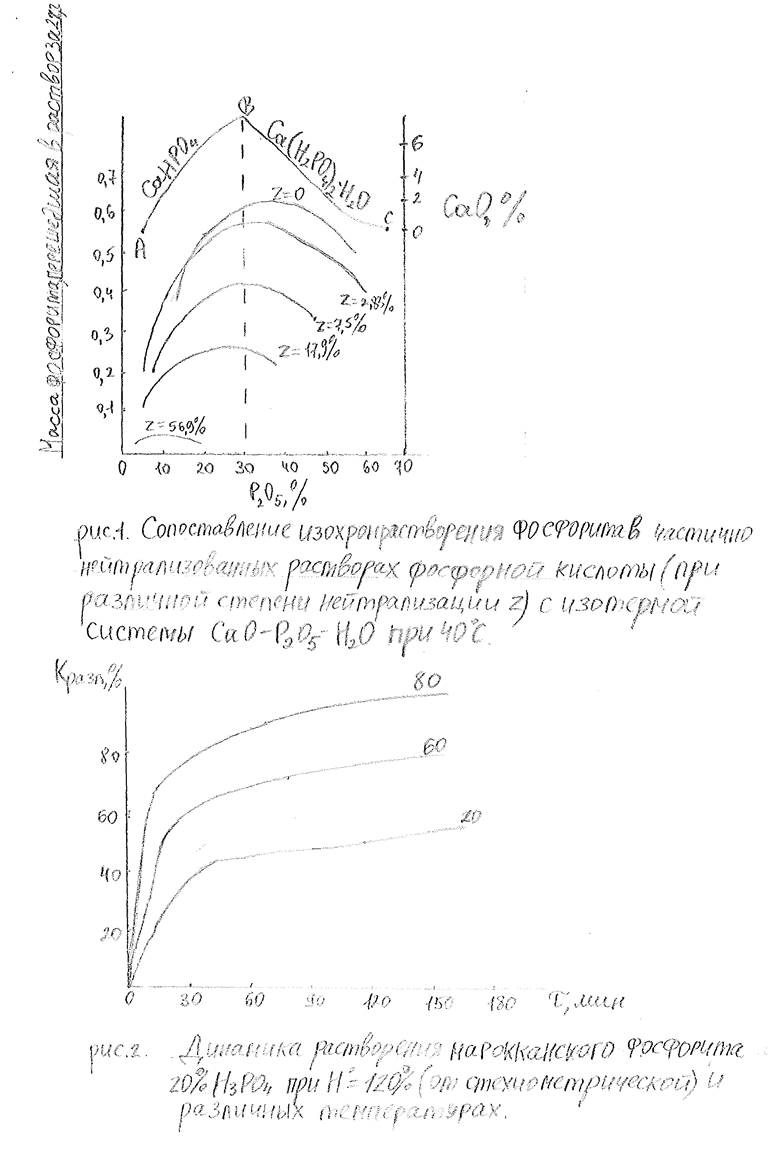
Как видно, взаимодействие реагентов вначале (первые 15-20 мин) идет быстро, а затем замедляется. При 900С за 3 часа обеспечивается практически полное вскрытие фосфата. Температурный коэффициент скорости растворения фосфорита для растворов, содержащих 20%Р205 составляет 1.3-1.5, а с повышением содержания Р205 до 52% увеличивается до 1.7.
Разложение природных фосфатов связано с образованием пересыщенных растворов>из которых по мере растворения фосфата должна протекать кристаллизация твердой фазы; содержание Р205 в жидкой фазе при этом будет уменьшаться. Степень пересыщения жидкой фазы определяется соотношением скоростей растворения и кристаллизации, в свою очередь зависящих от температурно-концентрационных условий процесса. Кристаллизация продуктов реакции и частицы природного фосфата пространственно отделены друг от друга, имеют сопоставимые размеры, и выделение твердой фазы практически не замедляет растворения фосфата. Это возможно при сравнительно высоких нормах расхода кислоты в области кристаллизации дигидрофосфата кальция. В данном случае скорость процесса определяется в основном, скоростью отвода продуктов реакции из пересыщенного ими пограничного слоя в объем раствора. С увеличением пересыщения кристаллизация может частично протекать непосредственно в предповерхностном слое, что приведет к появлению пленок на зернах фосфата и замедлению его разложения. Иной механизм образования незагустевающей пульпы реализуется, когда продукты реакции отлагаются преимущественно на зернах растворяющего фосфата. Это наблюдается, например, при использовании для разложения стехиометрической или близкой к ней нормы расхода фосфорной кислоты, содержащей не более 42% Р205.При таких условиях жидкая фаза равновесна с гидрофосфатом кальция, и создаются предпосылки для образования плотных покровов, тормозящих растворение. Степень разложения природного фосфата оказывается весьма низкой. Причиной торможения разложения фосфорита в разбавленной фосфорной кислоте является образование пленки гидрофосфата кальция. Такое торможение объясняют повышением температуры в зоне пограничного слоя по сравнению с температурой в объеме суспензии и обратной температурной зависимостью растворимости гидрофосфата кальция. [2]
Существует мнение о том, что термодинамическая невозможность перехода стабильной фазы в метастабильную наиболее веская причина при разложении фосфорита неупаренной экстракционной фосфорной кислотой. В поточном способе производства тройного суперфосфата, в котором получают и перерабатывают незагустевающие пульпы при близких к стехиометрическим нормам расхода фосфорной кислоты, содержащей 25- 39%Р205, марокканский фосфорит при таких условиях вскрывается медленно и в малой степени на 15-35%. В практике для производства тройного суперфосфата применяют преимущественно растворы экстракционной фосфорной кислоты, состав которых зависит как от наличия растворимых примесей в природных фосфатах, так и от режима ее получения. Кроме того, в жидкую фазу суперфосфатной массы частично переходят компоненты, содержащиеся во вторичном фосфатном сырье. Примеси оказывают то или иное воздействие на растворимость и кристаллизацию фосфатов кальция, активности воды и водородных ионов жидкой фазы, ее вязкость и другие свойства реакционных масс, тем самым влияя на скорость и полноту взаимодействия реагентов. Катионы металлов, нейтрализуя первый водородный ион фосфорной кислоты и уменьшая растворимость фосфатов кальция, как правило, отрицательно влияют на процесс разложения фосфатов. Наличие H2S04, H2SiF6 и HF,связывающих часть в малорастворимые соли, равнозначно увеличению нормы расхода фосфорной кислоты (повышению концентрации водородных ионов), т.е. должно способствовать ускорению растворения фосфатного минерала. Однако осаждение указанных солей на зернах минерала повышает вероятность образования труднопроницаемых покровов, затрудняющих диффузию водородных ионов. В связи с этим влияние перечисленных примесей в зависимости от температурно-концентрационных условий разложения, состав экстракционной фосфорной кислоты и структуры фосфата проявляется по-разному. Соединения магния оказывают сильное высаливающее действие на растворимость фосфатов кальция в фосфорной кислоте. Поэтому весьма существенным является их влияние на разложение природных фосфатов. Даже при очень больших избытках фосфорной кислоты, содержащей 40%Р205 при ее нейтрализации карбонатом магния на 30% К разл фосфорита при 40-90С уменьшается в 3-4 раза, а при нейтрализации на 50%—в 14-20 раз. На основании анализа растворимости солей в системе Ca0-P205-H2SiF6-H20 высказано предположение об интенсификации сложения фосфатов при содержании в фосфорной кислоте 6.5% фтора. Между тем отмечено ,что при наличие в фосфорной кислоте небольших количеств H2SiF6 (0.35-1.5% в пересчете на фтор)расширяется поле кристаллизации гидрофосфата кальция и возрастает вероятность фторида кальция. В результате реакция разложения может быть затруднена.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.