|
|
(29) |
то есть константа равновесия реакции (25) численно равна упругости диссоциации CaCO3, если последняя выражена в атмосферах.
Для анализа зависимости ![]() воспользуемся уравнением изобары химической
реакции
воспользуемся уравнением изобары химической
реакции
|
|
(30) |
Для процесса диссоциации
тепловой эффект ![]() , поэтому упругость диссоциации
растет с увеличением температуры. Изменение упругости диссоциации с
температурой показано на рис. 4.
, поэтому упругость диссоциации
растет с увеличением температуры. Изменение упругости диссоциации с
температурой показано на рис. 4.
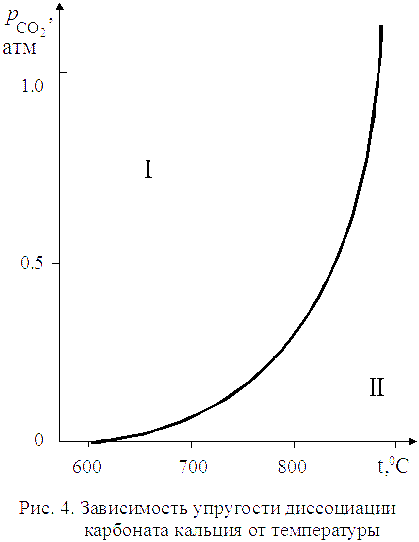 Линия
на рис. 4 характеризует условия равновесного сосуществования трех фаз:
Линия
на рис. 4 характеризует условия равновесного сосуществования трех фаз: ![]() . Если начать изменять не один параметр,
как разрешает правило фаз Гиббса, а два, то есть произвольно изменять и
температуру, и давление, равновесие системы будет нарушено. Области I и II на графике характеризуют условия равновесного
сосуществования уже только двух фаз (одной твердой и газообразной).
. Если начать изменять не один параметр,
как разрешает правило фаз Гиббса, а два, то есть произвольно изменять и
температуру, и давление, равновесие системы будет нарушено. Области I и II на графике характеризуют условия равновесного
сосуществования уже только двух фаз (одной твердой и газообразной).
Для области I характерны давления СО2 бόльшие, чем равновесные значения.
Следовательно, по
уравнению изотермы ![]() :
:
|
|
(31) |
Отсюда можно заключить, что в данных условиях протекает процесс карбонизации
|
|
(32) |
а прямой процесс (диссоциация)
невозможен. Иначе говоря, в области I устойчивой фазой является карбонат кальция. Таким образом, если при ![]() величина
величина ![]() станет
больше, чем
станет
больше, чем ![]() , то это приведет к исчезновению оксидной
фазы.
, то это приведет к исчезновению оксидной
фазы.
Проведя аналогичные
рассуждения для области II,
где ![]() , можно заключить, что при давлениях ниже
равновесного
, можно заключить, что при давлениях ниже
равновесного ![]() и развитие процесса диссоциации возможно.
Устойчивой фазой является в области II оксид
кальция
и развитие процесса диссоциации возможно.
Устойчивой фазой является в области II оксид
кальция ![]() .
.
Поскольку упругость диссоциации, выраженная в атмосферах, численно равна константе равновесия реакции, то ее значение можно теоретически рассчитать по уравнениям (21–24).
Величину теплового
эффекта при данной температуре (![]() ) можно рассчитать по
уравнению Кирхгофа (23).
) можно рассчитать по
уравнению Кирхгофа (23).
Среднюю величину
теплового эффекта реакции в изученном интервале температур (![]() ) можно также оценить по опытным значениям
константы равновесия при разных температурах (см. прил.2).
) можно также оценить по опытным значениям
константы равновесия при разных температурах (см. прил.2).
При анализе экспериментальных данных и их сопоставлении с рассчитанными по уравнениям (21–24) следует иметь в виду, что на величину упругости диссоциации оказывает влияние дисперсность твердых фаз. При измельчении твердой фазы возрастает ее энергия Гиббса, поскольку увеличивается доля частиц, располагающихся на поверхности кристаллов и обладающих избытком энергии. Принимая во внимание, что общее изменение энергии Гиббса по реакции равно
|
|
(33) |
можно заключить, что при измельчении
исходной фазы – карбоната (![]() растет) величина
растет) величина ![]() уменьшается, а при измельчении продукта
реакции (растет
уменьшается, а при измельчении продукта
реакции (растет ![]() )
) ![]() увеличивается.
Соответственно, в первом случае
увеличивается.
Соответственно, в первом случае ![]() растет, а во втором
падает, поскольку
растет, а во втором
падает, поскольку
|
|
(34) |
Методика и порядок проведения опытов
Для определения упругости диссоциации CaCO3 в работе используется статический метод. Суть его заключается в непосредственном измерении при данной температуре равновесного давления СО2 в установке.
Схема установки представлена на рис. 5. В электрическую печь сопротивления 1 помещают кварцевую ампулу 2, в которую помещена навеска карбоната 3. Перед началом нагрева печи из ампулы откачивают воздух форвакуумным насосом 4.
|
После выключения насоса в него надо обязательно запустить воздух с помощью крана 5. |
Кран 5 может
быть заменен струбцинами, пережимающими шланги. После этого задатчиком
терморегулятора 6 устанавливают первую заданную температуру. Когда заданная
температура достигнута (при этом лампочка на терморегуляторе начнет мигать),
делают выдержку не менее 10 минут и измеряют давление СО2 в
системе с помощью манометра 8. Изотермическая выдержка системы проводится для
достижения системой равновесия. При этом, по мере развития реакции, изменяется
(увеличивается) давление, а объем реакционного пространства остается
постоянным. Следовательно в данном случае процесс проходит при постоянном
объеме(V=const). Измеряемая в процессе работы ![]() определяется равновесным составом, который
не зависит от пути процесса, а определяется элементным составом системы,
давление и температурой. Потому
определяется равновесным составом, который
не зависит от пути процесса, а определяется элементным составом системы,
давление и температурой. Потому ![]() определенную в ходе
работы можно анализировать с помощью уравнения изобары и сравнивать с
рассчитанной.
определенную в ходе
работы можно анализировать с помощью уравнения изобары и сравнивать с
рассчитанной.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.