С помощью клапана 8 в бюретку 9 заливают титрующий раствор (водный раствор тиосульфата натрия) до выбранного уровня. К исследуемому раствору в колбе 7 добавляют 2 г KJ и 2 мл крахмала с помощью кнопки 10. При добавлении избытка KJ в исследуемый раствор вся медь содержащаяся в нем превращается в иодид и осаждается на дно сосуда.
|
2Cu 2+ +4I- = 2 CuI + I2 |
(47) |
В ходе этой реакции происходит выделение молекулярного йода J2 , который в присутствии крахмала придает раствору ярко синюю окраску.
Далее с помощью крана 11 начинают титрование, приливая титрующий раствор из бюретки в колбу 7. При этом осуществляется реакция:
|
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6. |
(48) |
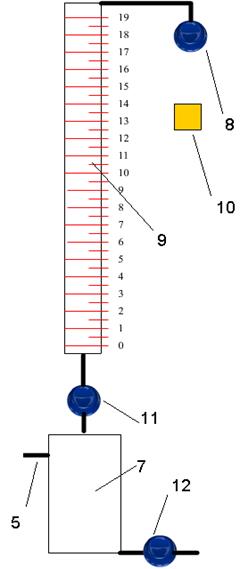
Тиосульфат натрия взаимодействует с йодом, уменьшая его количество. В момент времени, когда весь молекулярный йод прореагирует по реакции (48), окраска раствора резко изменит свой цвет с синего на бесцветный. Как только раствор обесцветился титрование прекращают и фиксируют потраченное количество титрующего раствора Vт. Зная концентрацию тиосульфата натрия (Na2S2O3) в титрующем растворе, равную 0,1 моль/л, рассчитывают по реакциям (1 и 2) концентрацию меди в исследуемом растворе Ср1. В соответствии с реакцией (47) 2 моля прореагировавших ионов меди приходится 1 моль выделившегося иода. И по реакции (48) для нейтрализации 1 моля иода необходимо 2 моля тиосульфата натрия.
Рис. 9. Схема установки для титрования
7 – колба, 9 – бюретка, 10 – добавление KJ,
8,11, 12 – клапаны
То есть 1 моль прореагировавших Cu2+ приведет к затратам при титровании 1 моль Na2S2O3:
|
|
(49) |
Следовательно концентрацию Ср1 можно определить по формуле:
|
Ср1= 0,1*Vт/20. |
(50) |
При выполнении работы на экране в правом
нижнем углу отображается начальная концентрация ионов меди в растворе
подаваемом в экстрактор C0 от 0,01 до 0,05 моль/л. До процесса
экстракции водный раствор содержал количество меди равное ![]() . После того как произошло перераспределение,
в растворе остались ионы меди в количестве
. После того как произошло перераспределение,
в растворе остались ионы меди в количестве ![]() .
Следовательно в органическую фазу перешло количество меди равное
.
Следовательно в органическую фазу перешло количество меди равное ![]() . Зная перераспределившееся количество
меди, определяют равновесную концентрацию меди в органической фазе Ср2.
. Зная перераспределившееся количество
меди, определяют равновесную концентрацию меди в органической фазе Ср2.
В емкости, где происходит разделение, остался раствор в количестве достаточном для повторного осуществления операции титрования. Поэтому клапаном 12 сливают из колбы 7 раствор после титрования и проводят химический анализ повторно. Определение концентрации меди в исследуемом растворе осуществляют 3 раза. По результатам трех измерений определяют средние значения концентраций.
Используя уравнение (46) находят коэффициент распределения ионов меди между водой и органической фазой для одной равновесной концентрации ионов меди в воде. Изменяя соотношения объемов органической фазы и водной (водный раствор добавляется в количестве 190, 180, 170, 160, 150 мл; органический до метки в 200 мл), изменяют равновесную концентрацию ионов меди. Определяют зависимость коэффициента распределения L от концентрации. Результаты измерения и расчетов помещают в таблицу 5.
Таблица 5
Результаты работы
|
№ опыта |
Количество раствора тиосульфата, V, мл |
Концентрация, моль/л |
Коэффициент распределения L |
|||||
|
№ пробы |
Vср, мл |
С0 |
Ср1 |
Ср2 |
||||
|
1 |
2 |
3 |
||||||
|
1 |
||||||||
|
2 |
||||||||
|
3 |
||||||||
|
4 |
||||||||
Вопросы для самоконтроля
1. Что называют константой распределения; от каких факторов зависит константа распределения?
2. Что называют коэффициентом распределения; в каком случае коэффициент распределения не зависит от состава раствора?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.