Данная формула получена
методом наименьших квадратов из условия: сумма квадратов отклонений
экспериментальных точек от прямой, проходящей через начало координат и имеющей
угловой коэффициент, равный ![]() , должна быть
минимальной. Для расчета
, должна быть
минимальной. Для расчета ![]() следует заполнить табл. 9.
следует заполнить табл. 9.
Таблица 9
К расчету опытного значения криоскопической постоянной
|
№ опыта |
K |
моль/кг |
моль2/кг2 |
моль×К/кг |
К2 |
|
1 2 … n |
Случайную
погрешность величины ![]() , найденной методом наименьших
квадратов, рассчитывают по формуле
, найденной методом наименьших
квадратов, рассчитывают по формуле
|
|
(79) |
Опытное значение
криоскопической постоянной сравнивают с рассчитанным по уравнению (78). Если
разница между ![]() и
и ![]() не
превосходит
не
превосходит ![]() , то можно пренебречь
систематической погрешностью. В противном случае следует оценить
систематическую погрешность δ:
, то можно пренебречь
систематической погрешностью. В противном случае следует оценить
систематическую погрешность δ:
|
|
(80) |
и по формуле (6), приведенной в третьей
части «Руководства», определить суммарную погрешность ![]() .
.
Затем требуется оценить целесообразное число значащих цифр в записи результатов измерений и представить результат с указанием погрешности.
Контрольные вопросы
1. Чему равно число степеней свободы при равновесии жидкого раствора с чистым твердым растворителем?
2. Чем определяется величина изменения температуры кристаллизации ΔТ?
3. Для каких растворов наблюдается линейная связь понижения температуры кристаллизации с моляльностью?
4. Каким образом природа растворенного вещества может повлиять на величину изменения температуры кристаллизации?
5. Как измерить температуру кристаллизации в данной работе?
6. От каких факторов зависит криоскопическая постоянная; от каких факторов криоскопическая постоянная не зависит?
ПРИЛОЖЕНИЕ 1. Термодинамические свойства некоторых веществ
|
Вещество |
|
|
|
||
|
|
|
|
|||
|
СО2 газ |
393,51 |
213,66 |
44,14 |
9.04 |
-8,79 |
|
СО газ |
110,53 |
197,55 |
28,41 |
4,10 |
-0,46 |
|
С граф |
0 |
5,74 |
16,86 |
4,77 |
-8,54 |
|
СаО тв |
635,09 |
38,07 |
49,62 |
4,52 |
-6,95 |
|
СаСО3 тв |
1206,83 |
91,71 |
104,52 |
21,92 |
-25,94 |
ПРИЛОЖЕНИЕ 2. Расчет величины ![]() в работах №1 и №2
в работах №1 и №2
Среднюю величину теплового эффекта
реакции в изученном интервале температур (![]() ) можно
оценить по опытным значениям константы равновесия при разных температурах. Для
этого необходимо проинтегрировать уравнение изобары химической реакции, считая
) можно
оценить по опытным значениям константы равновесия при разных температурах. Для
этого необходимо проинтегрировать уравнение изобары химической реакции, считая ![]() постоянным:
постоянным:
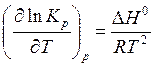 ,
,
после интегрирования получим
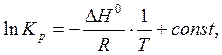
где ![]() –
постоянная интегрирования. Из данного соотношения следует, что опытные данные,
представленные в координатах «
–
постоянная интегрирования. Из данного соотношения следует, что опытные данные,
представленные в координатах «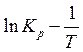 », должны располагаться
около прямой линии, угловой коэффициент которой
», должны располагаться
около прямой линии, угловой коэффициент которой ![]() равен
равен ![]() .
.
Следовательно, ![]()
При нахождении углового коэффициента
необходимо учесть, что масштаб оси абсцисс и оси ординат различен. Поэтому ![]() следует находить как отношение катетов
прямоугольного треугольника, длины которых выражены в единицах соответствующих
осей.
следует находить как отношение катетов
прямоугольного треугольника, длины которых выражены в единицах соответствующих
осей.
Таким образом,
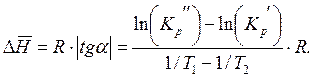
ПРИЛОЖЕНИЕ 3. Интегральные теплоты растворения некоторых солей в воде при 25ºС
|
Соль |
KI |
NH4Cl |
KCl |
NaCl |
|
|
20,59 |
15,23 |
17,55 |
4,25 |
Библиографический список
1. Жуховицкий А.А. Физическая химия / А.А. Жуховицкий, Л.А, Шварцман. М.: Металлургия, 2001. 688с.
2. Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П. Семченко. М.: Высшая школа, 1988. 496 с.
3. Карапетьянц М.Х. Химическая термодинамика / М.Х. Карапетьянц, М.: Химия, 1985. 580 с.
4. Краткий справочник физико-химических величин/ Под ред. А.А. Равделя и А.М. Пономаревой. СПб: Медный всадник, 2003. 240 с.
5. Зайдель А.Н. Погрешности измерений физических величин. Л.: Наука, 1985. 112 с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.