Здесь l ¹ ± 1. Энергии МО вычисляются аналогично случаю с гомоядерными двухатомными молекулами, путём решения вековых уравнений второй степени. Вместе с тем, с помощью условий, упомянутых ранее для образования гомоядерных молекул (близость энергий, максимальное перекрывание, согласованные свойства симметрии), легко указать какие АО yА и yВ могут комбинировать между собой. Кроме того, сохраняет прежний смысл классификация МО по типам симметрии (s, p), а также степень вырождения МО. Остаётся справедливым и правило непересечения, согласно которому уровни энергии МО одинаковой симметрии взаимно отталкиваются. И для гетероядерных молекул можно построить корреляционную диаграмму. Основное отличие её от соответствующей диаграммы для гомоядерных молекул: 1) В отсутствии свойств чётности (g и u), что связано с потерей центральной симметрии. 2) В различии энергий одинаковых орбиталей у разделённых атомов. Например, в молекуле NO связывающая МО s2s коррелирует с АО кислорода 2s, а разрыхляющая МО s*2s – с АО 2s азота, так как вследствие большего ядерного заряда энергетические уровни кислорода ниже соответствующих уровней азота. Образование молекулы NO из атомов N и О можно представить следующим образом:
N[1s22s22p3] + O[1s22s22p4] ® NO[KK(zs)2(ys)2(xs)2(wp)4(vp)] .
Эта молекула имеет один неспаренный электрон, поэтому она парамагнитна (её терм 2P).
8.10. Полярность орбиталей.
Для гетерополярной МО соответствует волновая функция
Y = yА + lyВ. (8.7)
Если ½l½ > 1, то можно сказать, что yВ вносит более существенный вклад в МО, чем yА, т.е. электронная плотность вблизи В больше, чем вблизи А. Соответствующая МО у ядра В имеет большую толщину, чем у ядра А. Очевидно, что l характеризует полярность орбитали и, следовательно, связана с величиной дипольного момента молекулы. Расчёты l весьма ненадёжны. Поэтому обычно l вычисляют из экспериментальных значений дипольного момента. Соотношение между l и дипольным моментом вытекает из следующих соображений. Плотность r зарядового облака электрона, находящегося на орбитали пропорциональна
![]() ,
,
где нормировочный множитель N определяется соотношением
![]() .
.
Среднее
значение координаты ![]() центра тяжести (от середины
прямой, соединяющей атомы А и В) зарядового облака вычисляется:
центра тяжести (от середины
прямой, соединяющей атомы А и В) зарядового облака вычисляется:
![]() ,
,
где R - расстояние между ядрами молекулы, а множитель xAB обычно очень мал и им пренебрегают. В этом случае распределение двух электронов на МО таково, что их центр “тяжести” находится на расстоянии
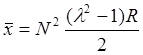
от средней точки молекулярной оси. Отсюда величина дипольного момента равна
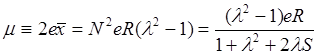 . (8.8)
. (8.8)
Данное соотношение, связывающее m и l, можно применять, если рассматриваемые два электрона являются единственными связывающими электронами и если поляризация, обусловленная другими не связывающими электронами мала.
Таблица 8.3. Значение коэффициента l в выражении МО yА + lyВ, вычисленные из экспериментальных данных о дипольных моментах по уравнению 8.8.
|
Молекула |
m/eR (эксп.) |
R×1010, м |
m, Дебай |
l (по 8.10) |
HF |
0.43 |
0.92 |
1.91 |
1.88 |
|
HCl |
0.17 |
1.27 |
1.03 |
1.28 |
|
HBr |
0.11 |
1.41 |
0.78 |
1.19 |
|
HI |
0.05 |
1.61 |
0.38 |
1.06 |
|
KCl |
0.47 |
2.79 |
6.3 |
2.0 |
Видно,
что для всех представленных в таблице галоидов l > 1. Однако, за исключением очень полярных молекул (HF, KCl) l не намного превышает единицу. Существует ещё другая, более простая, но
несколько менее точная интерпретация выражения 8.7. Полагают, что атомные
орбитали yА и yВ входят в
полную волновую функцию с относительными весами ![]() ,
вследствие чего часть электронного заряда, равная
,
вследствие чего часть электронного заряда, равная 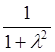 ,
находится вблизи ядра А, а часть, равная
,
находится вблизи ядра А, а часть, равная 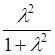 , -
вблизи ядра В. Если предположить, что центры “тяжести” этих зарядов
совпадают с ядрами, то дипольный момент, обусловленный двумя электронами с
таким распределением и положительными ядерными зарядами, будет равен
, -
вблизи ядра В. Если предположить, что центры “тяжести” этих зарядов
совпадают с ядрами, то дипольный момент, обусловленный двумя электронами с
таким распределением и положительными ядерными зарядами, будет равен
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.