Соединение |
Энергия связи эксперим., эВ |
Среднеариф. |
Среднегеом. |
l из дипольного момента |
||
|
Еков |
D |
Еков¢ |
D¢ |
|||
HF |
5.9 |
3.1 |
2.8 |
2.7 |
3.2 |
0.87 |
|
HCl |
4.5 |
3.5 |
1.0 |
3.4 |
1.1 |
0.45 |
|
HBr |
3.8 |
3.2 |
0.6 |
3.0 |
0.8 |
0.35 |
|
HI |
3.6 |
3.0 |
0.6 |
2.6 |
1.0 |
0.23 |
|
ClF |
3.8 |
2.1 |
1.7 |
2.0 |
1.8 |
|
|
LiF |
2.5 |
2.8 |
- 0.3 |
2.3 |
0.2 |
|
|
NaH |
2.3 |
2.6 |
- 0.3 |
1.9 |
0.4 |
|
Как показывают расчёты, трудно провезти резкую границу между двумя типами связи: чисто ионной и чисто ковалентной. Возможны все промежуточные степени полярности. Нет молекул с чисто ионной или чисто ковалентной связью. Если говорить о чисто ковалентной связи, то под таковой можно подразумевать связь, не имеющей полярности, что имеет место в гомоядерных молекулах. С другой стороны, даже для гомоядерных молекул наименьшее значение энергии даёт волновая функция, которая учитывает ионную составляющую: Y = yков + lyион. Нет соединений и с чисто ионной связью. Так, например, в CsF (одна из наиболее полярных молекул) доля ионного характера связи равна 91 %.
7.3. Шкала электроотрицательности.
Любому изолированному атому А можно приписать определённую величину, связанную со способностью притягивать электрон. Эта величина названа электроотрицательностью и обозначается xA. В свзи с этим гетероядерные молекулы в той или иной степени поляризованы. Так в молекуле HCl электрон сдвинут от Н к Cl. Используя понятие электроотрицательность можно меру ионного характера связи молекулы АВ выразить следующим образом:
xA - xB. (7.5)
Как эта величина соотносится с другой характеристикой ионности связи D (D¢) – энергией ионно-ковалентного резонанса? Полинг предложил следующее соотношение (в электронвольтах):
![]() .
(7.6)
.
(7.6)
Кроме шкалы электроотрицательностей Полинга, существует шкала электроотрицательности Малликена. Малликен предложил мерой электроотрицательности считать следующую величину:
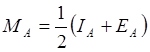 , (7.7)
, (7.7)
где IA – ионизационный потенциал и EA – электронное сродство. Оказалось, что
![]() .
(7.8)
.
(7.8)
Следует заметить, что в таблице элементов Д.И. Менделеева электроотрицательность увеличивается слева-направо и снизу-вверх. Полезно также соотношение между долей ионного характера связи Р и величиной xA - xB:
![]() . (7.9)
. (7.9)
Пользуясь эмпирическим соотношением 7.9, можно определить приблизительное значение дипольного момента для любой двухатомной гетероядерной молекулы.
8. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
ДВУХАТОМНЫЕ МОЛЕКУЛЫ
8.1. Молекулярные орбитали.
Исторически метод молекулярных орбиталей появился позже метода валентных связей и появление метода МО во многом было вызвано необходимостью описания экспериментальных данных по молекулярной спектроскопии. Этот метод был разработан Малликеном (1928), Ленардом-Джонсом (1929) и Гундом (1931). Метод молекулярных орбиталей исходит из предположения, что основная идея метода самосогласованного поля для атомов (метод Хартри-Фока) применима и к молекулам. Исходя из этого, каждый электрон можно рассматривать движущимся независимо от других электронов в усреднённом потенциальном поле U, созданным остальными электронами и ядрами. Поэтому собственная функция одного электрона распространяется на всю молекулу и называется молекулярной орбиталью (МО). Волновое уравнение молекулы в этом случае будет таково:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.