Определения ковалентности связи в рассматриваемых методах различны. В методе ВС ковалентность характеризуется волновой функцией с1yков(А-В) + с2yион(А- В+) + с3yион(А+ В-), когда с2 = с3. В методе МО используется волновая функция yа + lyb при l = 1. Из сказанного следует, что отрицательные заряды вблизи двух ядер равны между собой. Но это ещё не означает, что молекула не имеет дипольного момента. Помимо диполя, обусловленного ионными структурами, возможен гомеополярный диполь. Область перекрывания смещена к меньшей по размерам электронной орбите, где происходит накопление заряда. Т.к. этот заряд смещён от центрального положения оси, соединяющей ядра, то возникает электрический диполь.
Когда связь не ковалентная, то по методу ВС полярность выражается относительным весом основной ионной структуры в соответствии с волновой функцией:
Y = с1yков(А-В) + с2yион(А-В+) + с3yион(А+В-).
При с2 >> с3 можно записать
Y = yков(А-В) + lyион(А-В+).
И, как указывалось выше, доля ионности связи вычисляется так:
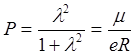 ; откуда
; откуда 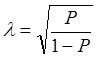 l.
l.
В случае метода МО ионность связи характеризуется коэффициентом lв волновой функции для молекулярной орбитали
Y = ya + lyb.
Здесь доля ионного характера связи вычисляется по уравнению:
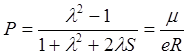 .
.
8.12.6. Насыщенность связи.
В методе ВС насыщенность связи естественно вытекает из того, что все электроны одного из атомов из валентной оболочки израсходованы для спаривания с электронами другого атома.
При использовании метода МО насыщенность связи напрямую неочевидна. Однако введение разрыхляющих молекулярных орбиталей позволяет объяснить насыщаемость.
8.12.7. Одно- и трёхэлектронные связи.
До сих пор мы рассматривали в основном двухэлектронные связи. Однако имеются молекулы с нечётным числом электронов, участвующих в образовании связи. Например, Н2+(s1s) или Li2+(s2s), где одна из дозволенных МО заполнена наполовину. Прочность одноэлектронных связей, как правило, вдвое меньше, чем у двухэлектронных. Трёхэлектронная связь рассматривается в рамках метода МО аналогичным образом. Так устойчивой является молекулярный ион Не2+(s1s)2(s*1s). Его прочность обусловлена удалением одного разрыхляющего электрона. В качестве другого примера можно привести молекулу NO. Разделённые атомы имеют следующую электронную конфигурацию: N(1s22s22px2py2pz) и О(1s22s22px2py2pz2), а молекула следующую:
NO [КК(2sN)2(2sО)2(s2px)2(p2py)2( p2pz)2( p*2pz)].
Здесь связь образована из 5 электронов (6 связывающих и 1 разрыхляющий). Связь в ионе NO+, в которой разрыхляющего электрона нет, прочнее, чем в нейтральной молекуле NO.
В методе ВС объяснение связи с участием нечётного числа электронов производится с привлечением двух структур связи с резонансом между этими структурами. Так для Н2+ одна структура представляет собой состояние, когда единственный электрон принадлежит первому ядру молекулы водорода, а вторая структура - электрон у второго ядра. В случае иона Не2+ три электрона связи дают структуры: первая – два электрона у атома А и один у атома В; вторая – один электрон у атома А и два электрона у атома В. Структуры такого типа не позволяют говорить о каком-либо спаривании электронов, принадлежащих различным ядрам. Возможно спаривание только в пределах каждой отдельной структуры. Если атомы разные (гетероядерная молекула), то энергии структур могут существенно различаться и условия резонанса не будут удовлетворяться.
Как правило, одно- и трёхэлектронные связи непрочны (за исключением случаев, когда они образуются между атомами с близкой электроотрицательностью). Трактовка таких связей по методу МО более проста и более удобна, чем по методу ВС.
В заключении следует отметить, что если исходные волновые функции в методах ВС отличаются, то при составлении более сложных комбинаций для увеличения точности вычислений получаются в общем-то эквивалентные волновые функции. Расчёты показывают, что при равновесном расстоянии для молекулы Н2 простейшие варианты методов ВС и МО дают результаты с приблизительно одинаковой точностью. В методе МО электронная корреляция недооценивается, а в методе ВС - переоценивается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.