ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
ФАЗОВЫЕ РАВНОВЕСИЯ:
Равновесие жидкость - пар в бинарных системах.
Курсовая работа по химической термодинамике
Выполнили:
Еремеева Елена Владимировна
Кондрачук Алина Игоревна
Научный руководитель:
Симонова Марина Владимировна
Новосибирск
2005 г.
ВВЕДЕНИЕ.. 3
ЛИТЕРАТУРНЫЙ ОБЗОР.. 3
Основные понятия, определения, законы.. 3
Условия фазового равновесия. 5
Фазовые равновесия в однокомпонентной системе. 5
Фазовые равновесия в многокомпонентной системе. 6
Критерий Рейдлиха-Кистлера. 9
Законы Коновалова. 10
Методы изучения зависимости давления пара от температуры.. 12
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.. 13
Оборудование. 13
Проведение экспериментов. 14
выводы... 18
ЛИТЕРАТУРА.. 18
Введение.
Химические процессы могут протекать сразу в нескольких фазах многокомпонентных систем. Сопоставление термодинамических свойств компонентов системы в различных фазах осуществляют с помощью понятия химического потенциала. Типичными многокомпонентными системами являются растворы – гомогенные молекулярно-дисперсные смеси переменного состава. Растворы могут быть газообразными, жидкими и твердыми, но обычно это понятие относят к жидким растворам.
В данной работе рассматривается фазовое равновесие в двухкомпонентной системе (изопропиловый спирт - толуол). Вариантность двухкомпонентной системы NF = 2 + 2 – 2 = 2. поэтому при фиксированных Т или Р значение вариантности NF = 1, т.е. на плоскостях-сечениях с Р = const или Т = const равновесия должны описываться кривыми сосуществования фаз.
Большой интерес представляют равновесные двухкомпонентные системы, в которых один из компонентов нелетуч. Если такой компонент растворен в летучем веществе – растворителе, то измерение температуры кипения раствора (эбулиоскопия – наблюдение кипения) обнаруживает ее повышение по сравнению с температурой кипения чистого растворителя.
Целью данной работы является, определение температуры кипения и равновесных составов жидкости и сосуществующего с ней пара при постоянном давлении. Построение по экспериментальным данным фазовой диаграммы (Т-х) для бинарной системы спирт-толуол.
Литературный обзор.
Основные понятия, определения, законы.
Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующая в отсутствие внешнего поля сил одинаковыми физическими и химическими свойствами во всех своих точках. При не слишком высоких давлениях, когда газы полностью смешиваются друг с другом, в системе может быть только одна газовая фаза, но несколько твердых и жидких фаз.
Компонент – индивидуальное химическое вещество, которое может быть выделено в чистом виде.
Число независимых химических компонентов – это наименьшее число индивидуальных химических веществ, необходимое и достаточное для образования всех фаз данной системы.
Вариантность системы – число независимых термодинамических переменных, которые можно независимо изменять, сохраняя фазовый состав (число фаз) системы.
Правило фаз дает следующую связь между вариантностью системы (W), числом независимых химических компонентов (К’) и числом фаз (Ф):
W = K’ – Ф + 2
Химический потенциал компонента (μi) – изменение свободной энергии Гиббса при добавлении к системе одного моля данного компонента при условии, что система поддерживается при постоянной температуре и давлении, а общее число молей вещества в системе очень велико:
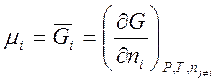 .
.
Если постоянными поддерживаются другие параметры, то химический потенциал может быть вычислен, как
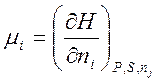 ,
, 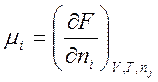 ,
, 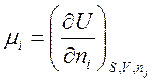 .
.
Здесь G – свободная энергия Гиббса; F – свободная энергия Гельмгольца; H – энтальпия; U – внутренняя энергия; S – энтропия; V – объем; T – температура; P – давление; n – число молей.
Парциальная мольная величина – это частная производная от любой экстенсивной переменной Ф по количеству i-го компонента (в молях) при постоянных давлении, температуре и числах молей остальных компонентов системы:
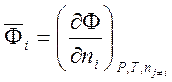 .
.
Общее (интегральное) значение свойства Ф выражается суммой вкладов всех компонентов
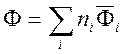 .
.
Парциальные мольные величины компонентов при постоянных Р и Т связаны уравнением Гиббса – Дюгема:
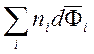 =0.
=0.
Уравнение Гиббса – Дюгема показывает, что изменения парциальных мольных величин при изменении состава системы являются взаимосвязанными.
Условие химического равновесия. Если в системе, содержащей вещества Аi возможна химическая реакция
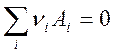 ,
,
то для их химических потенциалов выполняется соотношение
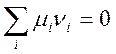 ,
,
где νi – стехиометрические коэффициенты.
Условия фазового равновесия.
Рассмотрим произвольную систему, находящуюся при постоянных температуре и давлении, и сформулируем условия фазового равновесия исходя из общего положения о минимуме потенциала Гиббса в состоянии равновесия при Р, Т = const.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.