НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Лабораторная работа Ф-1
ОПРЕДЕЛЕНИЕ ЗАВИСИМОСТИ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ И РАСЧЁТ ТЕПЛОТЫ ПАРООБРАЗОВАНИЯ.
Студент:
Чубаров А.С.
Шевелёв Г.Ю.
Преподаватель:
к.х.н. Рогов В.А.
НОВОСИБИРСК 2008 г.
Цель работы: определение температуры кипения, энтальпии и энтропии парообразования бутанола-1.
Экспериментальные данные:
|
Отсчет по манометру |
P атм |
Т кип, °С |
∆h = (hлев + hправ) /2 |
P = Pатм - ∆h, мм рт. ст. |
Ln P |
T, K |
10^3/T |
|
|
hлев |
h прав |
|||||||
|
490 |
410 |
758 |
86,80 |
450 |
308 |
5,7301 |
359,80 |
2,779322 |
|
440 |
418 |
90,80 |
429 |
329 |
5,796058 |
363,80 |
2,748763 |
|
|
405 |
378 |
95,10 |
391,5 |
366,5 |
5,903999 |
368,10 |
2,716653 |
|
|
340 |
322 |
99,00 |
331 |
427 |
6,056784 |
372,00 |
2,688172 |
|
|
278 |
256 |
102,90 |
267 |
491 |
6,196444 |
375,90 |
2,660282 |
|
|
238 |
226 |
104,20 |
232 |
526 |
6,265301 |
377,20 |
2,651113 |
|
|
182 |
178 |
106,50 |
180 |
578 |
6,359574 |
379,50 |
2,635046 |
|
|
141 |
140 |
108,50 |
140,5 |
617,5 |
6,425679 |
381,50 |
2,621232 |
|
|
88 |
94 |
110,05 |
91 |
667 |
6,50279 |
383,05 |
2,610625 |
|
|
34 |
46 |
113,05 |
40 |
718 |
6,57647 |
386,05 |
2,590338 |
|
|
6 |
8 |
115,10 |
7 |
751 |
6,621406 |
388,10 |
2,576656 |
|
Провели серию измерений температур кипения бутанола-1 при разных давлениях в системе. Данные приведены в таблице 1. Исходя из экспериментальных данных построили график зависимости температур кипения от давлений в координатах Y = ln(P), X = (10^3/T):
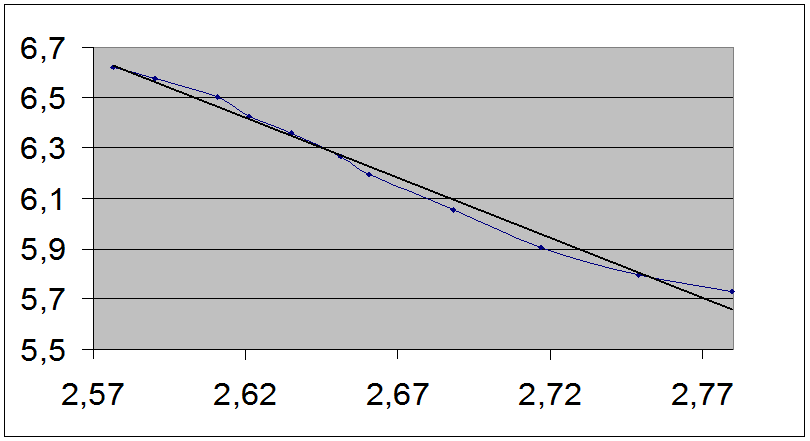
Из графика рассчитали нормальную температуру кипения (при давлении 760 мм рт. ст.), теплоту испарения, а так же нормальную энтропию испарения.
Расчет нормальной температуры кипения t
По графику определили, что температура кипения равна115,46 0С, или 388,61 К
Расчет теплоты испарения
LnP/P0 = - 1/R*(1/T – 1/T0)∆H, где P = 751 мм. рт ст., T = 388,25 K
Po=760 мм. тр. ст., То=388,61 К.
∆Hэксп=42 ± 3 КДж/моль
Расчет энтропии испарения
LnP/P0 = - 1/R*(1/T – 1/T0)∆H = -∆H/RT + ∆S0/R
T = 388,61 К, ∆H = 41489 Дж/моль, Р = 751 мм.рт.ст., P0 = 760 мм.рт.ст.
∆Sэксп = 106 ± 3 Дж/моль*К
∆U = ∆H - R∆T = 41,1 КДж/моль
ɛ = 2∆U/Z = ∆U/5 = 8,22 КДж/моль
Теоретический расчеты:
Справочные данные:
|
Вещество |
ΔrHº298 (кДж/моль) |
ΔrSº298 (Дж/мольּК) |
Cp = a + bּT +c*T2 |
||
|
A |
bּ103 |
cּ106 |
|||
|
Бутанол (ж) |
-325,56 |
225,73 |
183,26 |
- |
- |
|
Бутанол (г) |
-274.43 |
363,17 |
14,68 |
358,10 |
-129,00 |
Температура кипения бутанола tкип =117,5 0С, или 390,65 К
∆H0исп = ∆H0298 + ∆a*∆Т + ∆b*∆(T^2)/2 + ∆c*∆(T^3)/3 = 45510 Дж/моль = 45,5 КДж/моль
∆S0исп = ∆S0298 + ∆a*Ln(T/298) + ∆b*∆T + ∆c*∆(T^2)/2 = 120,865 Дж/моль*K
Выводы
В работе были определены температура кипения, энтальпия и энтропия парообразования бутанола-1. Экспериментальные результаты имеют некоторые отличия от теоретических вычислений.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.