– оценить ионную электропроводность ![]() . Для этой оценки следует использовать
значение
. Для этой оценки следует использовать
значение ![]() , определенное при выполнении первого
варианта работы или значение, взятое из справочника;
, определенное при выполнении первого
варианта работы или значение, взятое из справочника;
– определить эквивалентную электропроводность 0.01 н растворов ацетата калия и уксусной кислоты, сопоставить их со справочными данными.
Если работа выполняется в качестве курсовой, можно
изучить зависимость вида кривой титрования от исходной концентрации уксусной
кислоты и объяснить полученные результаты а также использовать другие слабые
одноосновные кислоты. Рекомендуется также получить более точное теоретическое
выражение для зависимости удельной электропроводности ![]() от
у в «кислой» области и сопоставить
его с экспериментальными данными.
от
у в «кислой» области и сопоставить
его с экспериментальными данными.
Порядок проведения измерений аналогичен варианту №1.
Вариант № 3. Титрование смеси сильной и слабой кислот. Рекомендуется использовать эквимолекулярную смесь соляной кислоты и уксусной кислоты. Обозначим их начальные концентрации, как aw (weak) и as (strong).
При титровании щелочью смеси соляной и уксусной кислот можно выделить три области.
«Кислая область 1» {y
< as }.Будем
считать в первом приближении, что в присутствии соляной кислоты диссоциация
уксусной кислоты подавляется, и она ведет себя как неэлектролит. При титровании
в растворе присутствуют ионы ![]() , K+ ,
, K+ , ![]() и
недиссоциированная уксусная кислота. При добавлении щелочи удельная электропроводность
раствора
и
недиссоциированная уксусная кислота. При добавлении щелочи удельная электропроводность
раствора ![]() линейно уменьшается. Ожидается, что её
зависимость от величины у примерно
такая же, как в варианте №1.
линейно уменьшается. Ожидается, что её
зависимость от величины у примерно
такая же, как в варианте №1.
«Кислая область 2» {as<
y < (as + aw)}. Можно
считать, что в этой области происходит титрование слабой (уксусной) кислоты, а
сильная кислота полностью оттитрована. Ожидается зависимость ![]() от
от ![]() подобная
наблюдавшейся в варианте №2.
подобная
наблюдавшейся в варианте №2.
«Щелочная область». {y > (as + aw)}. Обе кислоты оттитрованы, электропроводность раствора возрастает по мере добавления щелочи. При переходе к «щелочной области», как и в вариантах №1 и №2, на кривой титрования наблюдается излом, что позволяет легко определить суммарную концентрацию кислоты.
Переход от «кислой области 1» к «кислой области 2» выражен не так отчетливо, как переход к «щелочной области». Тем не менее, ориентировочно концентрация слабой кислоты также может быть определена.
Вариант № 4. Титрование двухосновной (например, щавелевой) кислоты. Если при диссоциации по первой ступени кислота ведёт себя как сильная, а по второй ступени – как слабая, то наблюдаемая картина титрования аналогична варианту №3.
Задача К-2
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ УКСУСНОЙ КИСЛОТЫ
Цель лабораторной работы – определить константу диссоциации уксусной кислоты кондуктометрическим методом при температуре 25 0 С.
В водных растворах уксусная кислота гидролизуется с образованием ионов ацетата и гидроксония
![]() .
.
Константа равновесия реакции гидролиза, выраженная через активности, определяется уравнением
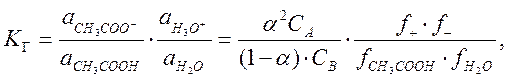 (10)
(10)
где СА – исходная
концентрация кислоты в моль / л; a – степень гидролиза; СВ – концентрация
воды; fi – коэффициенты активности; СА
<<. СВ. Поскольку в разбавленном растворе концентрация
воды постоянна, её можно включить в константу равновесия, которая в этом случае
называется константой диссоциации ![]() .
.
Если считать, что неидеальность раствора обусловлена
только эффектами теории Дебая–Хюккеля, то коэффициенты активности незаряженных
частиц: воды и недиссоциированной кислоты, можно положить равными единице, а
произведение коэффициентов активности катиона и аниона найти, вводя
среднеионный коэффициент активности ![]() :
:
![]() ,
, 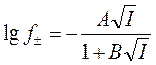 ,
,
где I – ионная сила раствора; A и B
– константы; ![]() –десятичный логарифм. При 25 0 С
для водного раствора 1,1-валентного электролита A = 0.509, B » 1.
–десятичный логарифм. При 25 0 С
для водного раствора 1,1-валентного электролита A = 0.509, B » 1.
Уравнение (10) можно переписать как
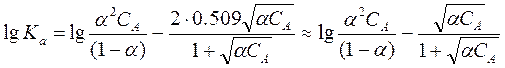
Учтено, что для 1,1-валентного электролита ионная сила равна произведению его концентрации на степень диссоциации.
Для нахождения степени диссоциации нужно использовать уравнение Дебая–Хюккеля–Онзагера (6), которое можно представить в виде
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.