В формулу (1), которой мы сейчас воспользуемся, входят величины: a – начальная концентрация этилацетата и b – начальная концентрация щелочи. Эти величины известны или могут быть рассчитаны при приготовлении растворов. Пусть, например, a = 0.0095M, b = 0.0202M.
Напишите на бумаге правую часть формулы (1),
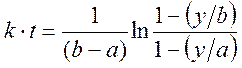 ,
,
введя в неё цифровые значения. При указанных вышедля примера величинах a и b она может выглядеть следующим образом (ваши значения a и b будут другими):
![]() . (21)
. (21)
Щелкните по заголовку колонки colG правой кнопкой мыши, выберите «SetColumnValues», вместо подсказки col(B) – col(A) наберите выражение (21), нажмите «Doit». Если в колонке не появились цифры – проверьте скобки в выражении (21); проверьте, что вы используете десятичную точку, а не запятую. Конечно, вместо a = 0.0095 и b = 0.0202 вы должны ввести в (21) ваши значения a и b.
Ну, вот и всё! Осталось построить график. Выделите колонку «G», щелкнув по ее заголовку левой кнопкой мыши. Щелкните по кнопке «Plot» и выберите «Scatter». Перед вами анаморфоза второго порядка. Измените названия осей. Для этого нужно дважды щелкнуть по имени оси левой кнопкой.
Чтобы провести прямую методом МНК, нажмите в главном меню кнопку «Analysis» и выберите «Fitlinear». Результаты из окна «Results» можно скопировать и перенести на график. Обычно график при больших временах выглядит некрасиво: кривая может куда-то загибаться и имеется большой разброс точек. Это нормально. Попросите преподавателя помочь провести прямую через точки на начальном участке. Из наклона прямой рассчитайте константу скорости второго порядка.
Сохраните свой Project. Щелкните по кнопке «File» и выберите «save» или «save as». Пожалуйста, сохраняйте ваши данные в директории C:\data2005\фамилия преподавателя\имя файла.
Другие варианты выполнения работы К-4
Описание метода обработки результатов дано для варианта 1, когда начальная концентрация этилацетата меньше начальной концентрации щелочи. Можно выполнять работу К-4 и при другом выборе начальных концентраций:
Вариант 2. Начальная концентрация этилацетата больше начальной
концентрации щелочи. ![]() . Работу можно выполнять по
описанию, данному для варианта 1. Поскольку щелочь в этом опыте расходуется
полностью и
. Работу можно выполнять по
описанию, данному для варианта 1. Поскольку щелочь в этом опыте расходуется
полностью и ![]() =
= ![]() , то нет
необходимости готовить раствор № 1. Достаточно измерить начальную
электропроводность, снять кинетическую кривую и измерить электропроводность после
завершения реакции.
, то нет
необходимости готовить раствор № 1. Достаточно измерить начальную
электропроводность, снять кинетическую кривую и измерить электропроводность после
завершения реакции.
Вариант 3. Начальная концентрация этилацетата равна начальной
концентрации щелочи. ![]() . Зависимость концентрации щелочи
от времени находят так же, как и для варианта 1. Однако, формула (1) не
пригодна для расчета константы скорости. Вместо неё следует использовать
соотношение:
. Зависимость концентрации щелочи
от времени находят так же, как и для варианта 1. Однако, формула (1) не
пригодна для расчета константы скорости. Вместо неё следует использовать
соотношение:
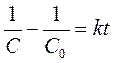 ,
,
где С и С0 – текущая и начальная концентрация щелочи (или, что то же, этилацетата).
Вариант 4. Начальная концентрация этилацетата много больше
начальной концентрации щелочи. ![]() . Работу можно выполнять,
аналогично варианту 2. Поскольку концентрация этилацетата мало меняется в ходе
реакции, её можно считать постоянной, а экспериментальные данные можно
обработать по уравнению псевдопервого порядка:
. Работу можно выполнять,
аналогично варианту 2. Поскольку концентрация этилацетата мало меняется в ходе
реакции, её можно считать постоянной, а экспериментальные данные можно
обработать по уравнению псевдопервого порядка:
![]() .
.
В этом случае использование процедуры, описанной в разделе «Аппроксимация данных избранной функцией», дает правильное значение характеристического времени реакции, из которого легко рассчитать константу скорости реакции.
Вариант 5. Определение порядка реакции по одному из реагентов из зависимости скорости реакции от концентрации этилацетата. Если начальная концентрация щелочи равна 0.02М, можно выбрать следующие начальные концентрации этилацетата: 0.005 М, 0.01 М, 0.02 М, 0.03 М, 0.05 М. Можно не снимать всю кинетическую кривую, а ограничиться начальным участком. Затем следует построить зависимость логарифма начальной скорости от логарифма начальной концентрации этилацетата, из наклона найти искомый порядок по этилацетату.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.