7. Ядерная статсумма:
так как активированный комплекс содержит те же ядра, что и исходные вещества, то ядерная статсумма сокращается, учитывать ее нет необходимости.
Величина ![]() , фигурирующая в формуле метода переходного
состояния, называется частотным фактором.
, фигурирующая в формуле метода переходного
состояния, называется частотным фактором.
5.7. Мономолекулярные реакции
Рассмотрим мономолекулярную реакцию в пределе высоких давлений.
![]()
Константа скорости такой реакции
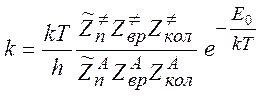
В пределе низких температур колебательные статсуммы
заморожены: ![]() , и
, и
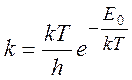
В пределе высоких температур колебательные статсуммы
сильно разморожены: ![]() , и
, и
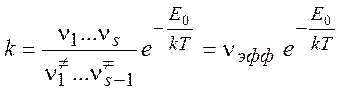
Если активированный комплекс более “рыхлый”, чем исходная молекула, - аномально высокий предэкспонент. Если активированный комплекс более “жесткий”, чем исходная молекула, - аномально низкий предэкспонент.
5.8. Бимолекулярные реакции
В случае “рыхлого” активированного комплекса выражение для константы скорости совпадает с предсказанием по теории столкновений (модель линии центров). В случае “жесткого” активированного комплекса появляется стерический множитель (порядка 10-2).
Глава 6. Типы элементарных реакций
6.1. Основные понятия
1. Реакции, протекающие с разрывом или (и) образованием одной связи.
2. Реакции, протекающие с разрывом или (и) образованием нескольких связей.
Гомолитические реакции – если разрываются или (и) образуются электронные пары (радикалы). Гетеролитические реакции – если электронные пары не разрываются или (и) не образуются (ионы).
6.2. Радикальные реакции
1) Распад молекулы на свободные радикалы, рекомбинация радикалов.
![]()
2) Образование радикалов при реакциях насыщенных молекул.
![]()
3) Радикальные реакции замещения.
![]()
4) Реакции присоединения радикалов.
![]()
Глава 7. Реакции в жидкости
7.1. Основные понятия
Нормальные жидкости – макроскопически однородны и изотропны. Основные отличия от газа:
1) сильное межмолекулярное взаимодействие;
2) жидкость занимает собственный объем;
3) эффект “клетки”
7.2. Химическая реакция и диффузия
Рассмотрим бимолекулярную реакцию в жидкости:
![]()
Пусть ![]() и
и ![]() - радиусы молекул A
и B;
- радиусы молекул A
и B; ![]() и
и ![]() - коэффициенты диффузии этих молекул.
Выберем начало координат в центре молекулы A и примем
ее радиус равным
- коэффициенты диффузии этих молекул.
Выберем начало координат в центре молекулы A и примем
ее радиус равным ![]() . Тогда молекулы B можно
рассматривать как точечные, имеющие коэффициент диффузии
. Тогда молекулы B можно
рассматривать как точечные, имеющие коэффициент диффузии![]() .
В установившемся стационарном режиме, скорость химической реакции равна
диффузионному потоку
.
В установившемся стационарном режиме, скорость химической реакции равна
диффузионному потоку ![]() точечных молекул B на сферическую молекулу A
на расстоянии R от ее
центра. При этом концентрация молекул B на
расстоянии R равна
точечных молекул B на сферическую молекулу A
на расстоянии R от ее
центра. При этом концентрация молекул B на
расстоянии R равна
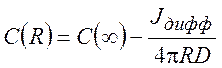 (7.1)
(7.1)
Для диффузионного потока имеем
![]() (7.2)
(7.2)
Отсюда следует, что
![]() (7.3)
(7.3)
где
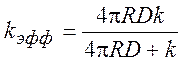 (7.4)
(7.4)
Из этой формулы видно, что существует два крайних случая – диффузионый предел и кинетический предел для реакции.
Более детальное рассмотрение процесса диффузии при наличии реакции позволяет определить характерное время установления стационарного режима, когда начинает работать формула (7.4):
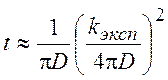 (7.5)
(7.5)
7.3. Эффект “клетки”
Эффект “ клетки” описывается обычно посредством следующей кинетической схемы:
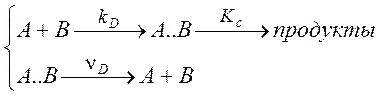 (7.6)
(7.6)
Для ![]() получаем:
получаем:
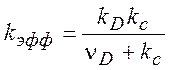 (7.7)
(7.7)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.