Простейший реактор идеального вытеснения – трубка постоянного сечения. При этом предполагается, что все переменные – концентрации веществ и скорость потока – постоянны в каждом фиксированном сечении трубы и зависят только от одной координаты x. Уравнение (4.10) в этом случае имеет следующий вид:
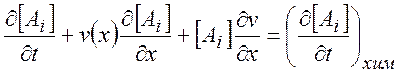 (4.11)
(4.11)
Мы будем рассматривать только стационарный режим реактора:
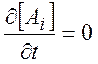 (4.12)
(4.12)
Рассмотрим реакцию изомеризации
![]()
Учитывая (4.12), уравнение (4.10) дает:
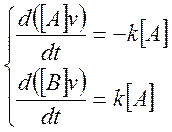 (4.13)
(4.13)
Решение имеет вид:
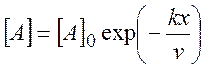 (4.14)
(4.14)
Глава 5. Механизм элементарного химического превращения
5.1. Приближение Борна-Оппенгеймера
Рассмотрим бимолекулярную реакцию
![]()
Для нахождения константы скорости этой реакции необходимо решить полную квантово-механическую задачу о движении всех ядер и электронов, содержащихся в этих молекулах. Данная задача является очень сложной даже для простейших систем. Однако, из-за большого различия в массах ядер и электронов она может быть существенно упрощена с помощью адиабатического приближения (приближения Борна-Оппенгеймера). Это приближение строится в два этапа:
1) положения ядер
считаются фиксированными, находится энергия системы, зависящая от координат
ядер как от параметров, - ![]() ;
;
2) движение ядер в
потенциале ![]() может рассматриваться как
квантово-механически, так и классически.
может рассматриваться как
квантово-механически, так и классически.
5.2. Поверхность потенциальной энергии
Рассмотрим подробнее структуру
потенциала ![]() . Так как трансляция и поворот системы как
целого не изменяют суммарной энергии,
. Так как трансляция и поворот системы как
целого не изменяют суммарной энергии, ![]() зависит
реально от 3N-6 координат и может быть
представлена в виде поверхности в 3N-5 –мерном
пространстве (поверхность потенциальной энергии, ППЭ).
зависит
реально от 3N-6 координат и может быть
представлена в виде поверхности в 3N-5 –мерном
пространстве (поверхность потенциальной энергии, ППЭ).
Химическая реакция - это переход из области ППЭ, соответствующей исходным веществам (“долина исходных веществ”) в область, соответствующую продуктам (“долину продуктов”). Существует множество путей для такого перехода, но среди них есть один, наиболее экономичных с точки зрения энергии. Обозначим длину вдоль этого пути q и назовем ее координатой реакции. Зависимость энергии от координаты реакции может иметь барьер (точку перевала). Если от точки перевала смещаться перпендикулярно координате реакции, это будет приводить к повышению энергии. Такой барьер называется активационным барьером. Для некоторых реакций (например, для реакции диссоциации молекул на радикалы и пр.) барьер может отсутствовать.
5.3. Модель линии центров
Рассмотрим следующую модель. Будем считать. Что сечение зависит только от относительной поступательной энергии реагентов Et. Реагирующие молекулы рассматриваются как шары радиуса RA и RB . Считается, что реакция протекает только в том случае, если кинетическая энергия, соответствующая компоненте скорости, направленной вдоль линии, соединяющей центры шаров (т.е. перпендикулярной их поверхности) превосходит E0 (энергию активации). Таким образом, условие протекания реакции таково:
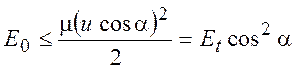 (5.1)
(5.1)
Итак, эта модель дает для сечения следующую зависимость от поступательной энергии реагентов:
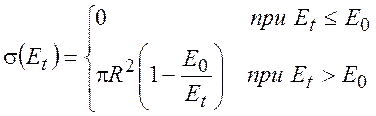 (5.2)
(5.2)
где
![]()
Чтобы найти константу скорости, подставим (5.2) в формулу (1.22). Получим
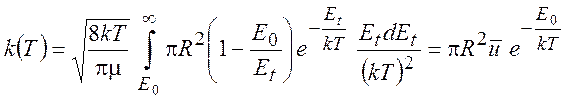 (5.3)
(5.3)
где ![]() – средняя относительная
скорость молекул:
– средняя относительная
скорость молекул:
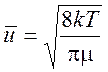
Обозначая
![]() (фактор
двойных столкновений) (5.4)
(фактор
двойных столкновений) (5.4)
получим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.