положительных значений и уменьшает поверхностное натяжение, особенно заметно при потенциалах, более отрицательных, чем потенциал точки максимума. По достижении достаточно положительных потенциалов эффект этих катионов исчезает. Присутствие амилового спирта изменяет форму электрокапиллярной кривой главным образом в области потенциалов, примыкающих к потенциалу максимума. С удалением в обе стороны от потенциала электрокапиллярного максимума эффект добавки амилового спирта снижается и кривая, снятая с добавкой спирта, совпадает с кривой для чистого раствора. Ионные или молекулярные соединения, оказывающие подобное действие, называются специфически адсорбирующимися или поверхностно-активными ионами или молекулами (данные последних лет показывают, что на границе ртуть — водный раствор электролита все анионы, за исключением иона фтора F-, являются поверхностно-активными. Однако поверхностная активность анионов NO3-, SO2-4, а также некоторых других очень мала, и в большинстве случаев ею можно пренебречь). Не поляризуемый электрод отвечает такому электроду, для которого обмен потенциал определяющими ионами между металлом и раствором совершается беспрепятственно, что наблюдается при больших токах обмена. Потенциал подобного электрода практически не изменяется под действием внешнего тока, пока величина последнего мала по сравнению с током обмена. Идеально поляризуемым является электрод, у которого обмен ионами полностью или почти полностью заторможен и ток обмена близок к нулю. Для такого электрода уже ничтожно малый внешний ток будет изменять потенциал. Ртутный электрод в условиях снятия электрокапиллярных кривых ведет себя подобно идеально поляризуемому электроду, хотя ток обмена между металлической ртутью и раствором ее соли в состоянии равновесия очень велик. Это объясняется следующими двумя причинами: во-первых. тем, что область потенциалов, в которой снимаются электрокапиллярные кривые, смещена в отрицательную сторону от равновесного потенциала ртутного электрода, и поэтому анодный процесс перехода ионов ртути из металла в раствор термодинамически невероятен; во-вторых, тем, что электрокапиллярные кривые снимаются в растворах, практически лишенных ионов ртути. В этих условиях катодный процесс перехода ионов ртути из раствора на металл также невозможен.
Электрокапиллярные свойства границы ртуть — раствор электролита можно объяснить, если допустить, что в отсутствии внешней э.д.с. ртуть при потенциале ε1 оказывается заряженной положительно по отношению к раствору (рис. 33, а). Избыточный положительный заряд ртути связан, вероятнее всего, с ионами ртути, находящимися у ее поверхности (со стороны металла). Система в целом, так же как и входящая в нее поверхностная фаза, должны подчиняться закону электронейтральности. Поэтому со стороны раствора у границы раздела будет избыток отрицательных ионов, компенсирующий положительные ионы ртути, находящиеся на металле. Присутствие одноименно (положительно) заряженных ионов ртути на поверхности металла неизбежно приводит к появлению отталкивательных сил, и поверхностное натяжение на границе ртуть — раствор не может быть высоким; на рис. 33 оно отвечает некоторой величине σ1
При наложении внешней э.д.с. потенциал ртути сместится вследствие ее катодной поляризации в сторону более отрицательных значений, например до величины ε2 (рис. 33, б). Часть ионов ртути при этом будет нейтрализована электронами и ее заряд, оставаясь положительным, соответственно снизится. Это уменьшит силы отталкивания между поверхностными ионами ртути, а следовательно, повысит поверхностное натяжение, например, до величины σ2. Одновременно уменьшится число отрицательных ионов,
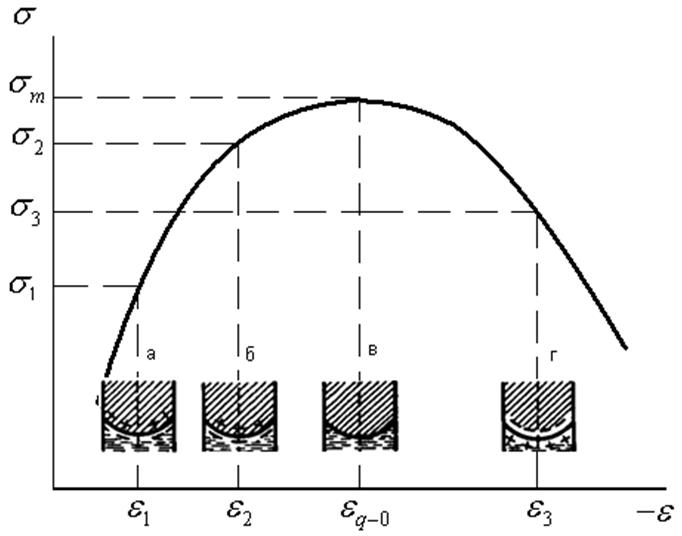
Изменение заряда поверхности ртути при переходе от восходящей ветви электрокапиллярной кривой к нисходящей.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.