Обе величины, входящие в правую часть уравнения (Х-58), должны быть, естественно, выражены в одной и той же условной, например, в водородной шкале; величина φ-потенциала при этом не зависит от выбранной условной шкалы.
Поскольку для различных металлов величины εΝ не совпадают, (см. табл. 40—41), то у каждого металла должна быть своя собственная приведенная шкала, основанная на его нулевой точке. Приведенная или φ-шкала потенциалов отличается, таким образом, и от любой условной, и от абсолютной шкалы потенциалов. Это различие отчетливо проявляется при сопоставлении значений стандартных электродных потенциалов ряда металлов в водородной, абсолютной и приведенной шкалах (табл. 39).
Из табл. 39 следует, что в водородной и абсолютной шкалах порядок расположения металлов по возрастающему положитель-
Таблица 39.
Стандартные потенциалы некоторых металлов в различных шкалах, в
|
Электрод |
Водородная шкала |
Абсолютная шкала |
Приведённая шкала |
|
|
-0.76 |
-0.76-(-0.20)= -0.56 |
-0.76-(-0.63)= -0.13 |
|
|
-0.44 |
-0.44-(-0.20)= -0.24 |
-0.44-(+0.0)= -0.44 |
|
|
-0.40 |
-0.40-(-0.20)= -0.20 |
-0.40-(-0.7)= +0.3 |
|
|
-0.34 |
-0.34-(-0.20)= -0.14 |
-0.34-(-0.8)= +0.46 |
|
|
+0.80 |
0.80-(-0.20)= +1.00 |
0.80-(-0.20)= -1.00 |
|
|
+0.80 |
0.80-(-0.20)= +1.20 |
0.80-(-0.4)= +1.20** |
* За нулевую точку железа принята не —0,38 β (см. табл. 37), а более вероятная величина, равная нулю.
** За нулевую точку серебра принята не табличная величина —0,76 в, а более вероятная, равная —0,4 в.
ному значению стандартного электродного потенциала, а также разности потенциалов между двумя любыми электродными потенциалами остаются одними и теми же. В приведенной шкале потенциалов порядок расположения металлов и разности в величинах их стандартных электродных потенциалов совершенно иные, так как физический смысл величины потенциала в любой условной (и абсолютной) шкале и в приведенной шкале совершенно различен. В то время как условная шкала относит величины потенциалов к одному определенному электроду, потенциал которого принят за нуль, в приведенной шкале для каждого электрода потенциал отсчитывается от своего собственного нуля, равного нулевой точке этого металла. Неверно поэтому применять φ-шкалу потенциалов для решения проблем, связанных с термодинамикой электрохимических систем или с электродным равновесием и пытаться использовать ее вместо водородной шкалы или ε-шкалы потенциалов. Приведенная шкала не позволяет, например, определить направление реакции и величину э.д.с. равновесной электрохимической системы, составленной из двух электродов с известными значениями φ-потенциалов. Эту задачу легко решить при помощи ε-шкалы. Однако потенциал в ε-шкале не дает сведений ни о заряде поверхности металла, ни о структуре двойного электрического слоя, ни о том, какова наиболее вероятная электрическая природа тех частиц, которые при данных условиях должны преимущественно адсорбироваться на поверхности электрода. Эти (и другие) сведения особенно важны для понимания неравновесных электродных процессов и их можно получить, пользуясь φ-шкалой протенциалов. Исходя из определения φ-потенциала (Х-58) и учитывая, что потенциал ε, отличный от потенциала εn, дается уравнением
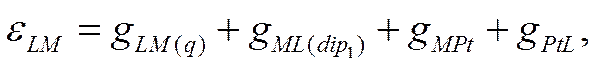
![]()
получим следующее выражение для потенциала электрода в φ-шкале:
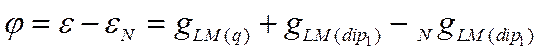
![]()
Уравнение (X-60) позволяет рассматривать потенциал электрода в φ-шкале как меру заряда металла (интенсивности ионного двойного слоя qLM(q)) и как меру изменения ориентации полярных молекул растворителя на границе металл — электролит при переходе от нулевой точки к данному значению потенциала (разность величин qLM(dip1) и NqLM(dip1)· Полагают, что ориентация диполей растворителя на незаряженной поверхности металла мало зависит от его природы и для всех металлов в водных растворах NqLM(dip1) примерно одно и то же. Таким образом, если, например, для металла 1 и металла 2
φ1=φ2
__________________________
* Уравнения (Х-59) и (Х-60) относятся к растворам, не содержащим поверхностно-активных веществ (gLM(s) = 0)·
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.