|
Оттитровано железа, % |
9 |
50 |
91 |
99 |
100 |
101 |
110 |
|
Е, в |
0,71 |
0,77 |
0,83 |
0,88 |
1,26 |
1,34 |
1,36 |
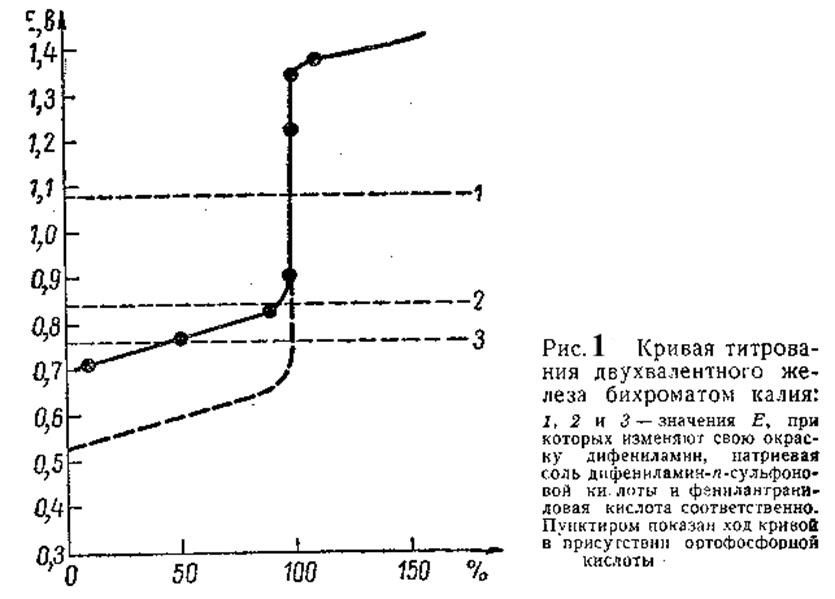 |
Кривая титрования (см. рис.1.) имеет скачок титрования в пределах от 0,9 до 1,3 в. Приведенная кривая рассчитана для титрования 0,1 M раствора двухвалентного железа раствором бихромата калия той же полярности. Однако, проследив за ходом расчета, легко заключить, что при изменении концентрации растворов ход кривой титрования практически не изменится. Построенная кривая титрования является основой для выбора индикатора.
Окислительно-восстановительные индикаторы
В бихроматометрии, так же как и во многих других методах для установления" точки эквивалентности применяют обратимые окислительно-восстановительные индикаторы, изменяющие свою окраску в зависимости от окислительно-восстановительного потенциала.
В настоящее время известно большое число различных индикаторов такого рода, важнейшими из них являются производные дифениламина, бензидина и нафтидина, некоторые комплексы неорганических ионов с органическими лигандами и др.
Дифениламин в кислых водных растворах под действием сильных окислителей необратимо окисляется до дифенилбензидина.
Дифениламин и образующийся в этой реакции дифенилбензидин бесцветны и поэтому не влияют на окраску раствора.При дальнейшем окислении дифенилбензидин уже обратимо окисляется, переходя в фиолетовую форму дифенилбензидина. Бесцветная и фиолетовая формы дифенилбензидина являются окислительно-восстановительной системой. Резкое изменение окраски этого индикатора, обусловленное превращением одной формы в другую, происходит при окислительно-восстановительном потенциале 0,76±0,1в
Дифениламин малорастворим в воде (около 0,06 мг/л), но довольно хорошо растворим в концентрированной серной кислоте. Поэтому для практических целей его обычно приготовляют в виде сернокислого раствора. Недостатком дифениламина является то, что он при избытке окислителя постепенно необратимо окисляется в продукты неизвестного состава, имеющие зеленую окраску.
Индикаторами этой группы являются также фенилантраниловая кислота и дифениламин-n-сульфоновая кислота в виде ее натриевой соли.
Фенилантраниловая кислота хорошо растворима в щелочах, для стабилизации щелочных растворов этого индикатора добавляют хлороформ. Фенилантраниловая кислота при окислении переходит из бесцветной формы сначала в красную, а затем в красно-фиолетовую. Переход происходит при окислительно-восстановительном потенциале 1,08 в. Натриевую соль дифениламин-n-сульфоновой кислоты используют в виде водного раствора. Этот индикатор изменяет свою окраску при потенциале 0,84 в, переходя из бесцветной (восстановленной) формы в красно-фиолетовую (окисленную) форму.
На рис.1 потенциалы, при которых рассмотренные выше индикаторы меняют окраску, отмечены горизонтальными линиями. Линия 3 относится к дифениламину, линия 2—к натриевой соли дифениламин-n-сульфоновой кислоты и линия 1— к фенилантраниловой кислоте.
Сопоставление потенциалов изменения окраски индикаторов с кривой титрования двухвалентного железа бихроматом калия дает возможность определить пригодность того или иного индикатора. Как следует из представленного графика на рис.1, дифениламин переменит свою окраску, когда будет оттитровано всего около 50% железа; натриевая соль дифениламин-n-сульфоновой кислоты изменит свою окраску при оттитровывании около 95% железа и только фенилантраниловая кислота изменит свою окраску в точке эквивалентности.
Таким образом, индикатором, пригодным для титрования железа бихроматом калия, является только фенилантраниловая кислота. Однако, если во время титрования одновременно проводить связывание ионов трехвалентного железа, повышающее окислительно-восстановительный потенциал, можно значительно .понизить левую ветвь кривой титрования (показано пунктиром на рис....). Это достигается введением в раствор ортофосфорной кислоты. При наличии в растворе ортофосфорной кислоты для установления точки эквивалентности можно пользоваться даже дифениламином.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.