Таблица
Константы устойчивости комплексов
некоторых металлов с ЭДТУК
|
Ионы |
Zr4+ |
Fe3+ |
Bi3+ |
Cr3+ |
Th4+ |
Pb2+ |
Cu2+ |
|
lgКМеY |
29,5 |
25,1 |
27,9 |
23,0 |
23,1 |
18,0 |
18,8 |
|
Ионы |
Zn2+ |
Cd2+ |
Ni2+ |
Al3+ |
Ca2+ |
Mg2+ |
Ba2+ |
|
lgКМеY |
16,5 |
16,5 |
18,6 |
16,1 |
10,7 |
8,7 |
7,8 |
Устойчивость комплексов металлов различна, зависит от иона металла, его заряда и электронной конфигурации и меняется в зависимости от рН среды. Наиболее устойчивые комплексы (Вi3+, Th4+, Fe3+, Cr3+ и др.) могут образовываться и в кислой среде. Менее устойчивые комплексы образуют ионы щелочноземельных металлов, которые комплексонометрически можно титровать только в щелочной среде.
Эффективная (условная) константа устойчивости
Это понятие относится к комплексам металлов с ЭДТУК и учитывает влияние рН на условия образования комплексов. Поскольку ЭДТУК представляет собой слабую четырехосновную кислоту (Н4Y), то в водных растворах она может диссоциировать (протонировать) по следующим ступеням:
![]()
![]() Н4 Y Н3Y-
+ Н+ К1 =
Н4 Y Н3Y-
+ Н+ К1 = 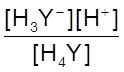 = 1×10-2 рК1 =
2,0
= 1×10-2 рК1 =
2,0
![]()
![]() Н3Y - H2Y2-
+ H+ K2 =
Н3Y - H2Y2-
+ H+ K2 = 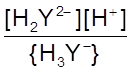 = 2,1×10-3 рК2 =
2,67
= 2,1×10-3 рК2 =
2,67
![]()
![]() Н2Y2-
HY3- + H+ K3 =
Н2Y2-
HY3- + H+ K3 = 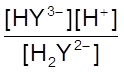 =
6,9×10-7 pK3
= 6,16
=
6,9×10-7 pK3
= 6,16
![]()
![]() HY3- Y4-
+ H+ K4
=
HY3- Y4-
+ H+ K4
= 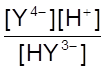 = 5,5×10-11
pK4 = 10,26,
= 5,5×10-11
pK4 = 10,26,
где К1 ... К4 - ступенчатые константы ионизации.
В соответствии с их значениями ЭДТУК в значительной степени ионизирует по первым двум ступеням и гораздо меньше - по третьей и четвертой ступеням. Поэтому в кислой среде (рН 3-6) ЭДТУК находится в основном в виде ионов Н2Y2-, в слабощелочной (рН 8-9) образует ионы НY3- и в сильнощелочной (рН > 12) - в виде свободных анионов Y4-.
Суммарная константа, являющаяся произведением отдельных констант, равна 8,0×10-22, что соответствует рКобщ = 21,1. Эта константа соответствует реакции ионизации
![]()
![]() Н4Y
Y4- + 4Н+ Кобщ =
Н4Y
Y4- + 4Н+ Кобщ = 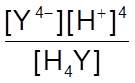 = 8×10-22,
= 8×10-22,
из которой четко видна сильная зависимость концентрации комплексообразующих ионов Y4- от кислотности среды.
Концентрация Y4- сильно понижается при повышении кислотности среды и поэтому в кислой среде комплексуются только ионы металлов, образующих очень прочные комплексы с ЭДТУК (или трилоном Б).
Рассмотрим влияние кислотности среды на прочность образуемых комплексов. Это влияние можно учесть с помощью коэффициента побочной реакции a, представляющего из себя отношение концентрации свободных ионов [Y4-] к общей концентрации всех форм ЭДТУК - СY:
a
= 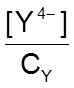 ,
,
где СY = [H4Y] + [H3Y-] + [H2Y2-] + [HY3-] + [Y4-]
Иначе говоря, a - это доля или степень использования ЭДТУК от всего взятого ее количества непосредственно для реакции образования комплекса металла
Y4- + Me2+ ® MeY2-,
зависящая от рН среды, в которой происходит взаимодействие.
Используя выражение для констант ступенчатой ионизации ЭДТУК, попытаемся рассчитать величину коэффициента побочной реакции. При этом концентрации различных форм ЭДТУК в растворе будут равны:
[H4Y] = 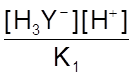 ;
;
[H3Y-] = 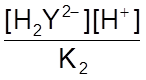 ;
;
[H2Y2-] = 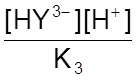 ;
;
[HY3-] = 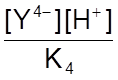 .
.
Выразим эти концентрации через концентрацию свободных анионов ЭДТУК (Y4-):
[HY3-] = 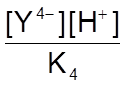 ;
[Н2Y2-] =
;
[Н2Y2-] = 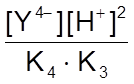 ;
;
[H3Y-] = 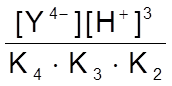 ;
[H4Y] =
;
[H4Y] = 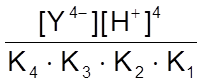
Теперь можем записать:
СY = [Y4-] × (1 + 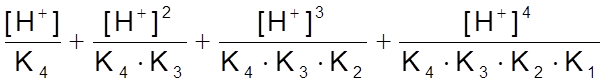 и
и
a = 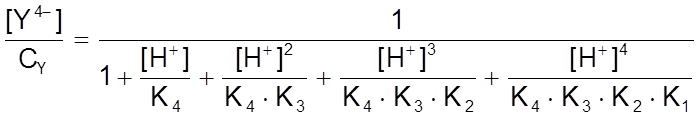 ... (1)
... (1)
По выведенному нами уравнению (1) рассчитываем величину коэффициента побочной реакции для рН = 1.
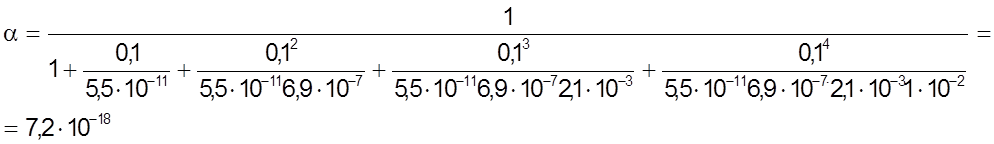
Подобным же образом можно рассчитать величину a и для других значений рН, поддерживаемых при комплексонометричеком титровании с помощью буферных растворов.
Зная справочную величину константы устойчивости комплекса металла с ЭДТУК и зная величину коэффициента a для данного значения рН легко рассчитать эффективную (условную) константу устойчивости комплекса металла по уравнению
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.