В белках наиболее часто фосфорилируются остатки серина, треонина и тирозина в примерном соотношении 1000:100:1. Однако, хотя уровень фосфорилирования тирозина незначителен, эта реакция приобрела важное значение в механизмах внутриклеточной сигнализации (реакции фосфорилирования тирозина рецепторных белков при участии тирозинкиназ).
Остатки тирозина в некоторых белках могут сульфатироваться . Примерами таких белков могут быть фибриноген или гастрин. Донором сульфата для белков, как и при сульфатировании других молекул является 3 '-фосфоаденозил-5 '-фосфосульфат (ФАФС). Присоединение сульфата к остаткам тирозина необходимо для проявления функции белков и является необратимым процессом в отличие от фосфорилирования тирозина , используемого в регуляторных механизмах клетки.
Пренилирование представляет присоединение 15 углеродной фарнезильной или 20 углеродной геранилгеранильной групп к акцепторным белкам. Фарнезил и геранилгеранил - изопреноиды, получаемые на пути синтеза холестерина. Изопреноидные группы присоединяются к остаткам цистеина на С конце белков тиоэфирной связью (C-S-C). Общая консенсусная последовательность на C - конце белков, подвергающихся пренилированию, представлена последовательностью CAAX, где C – цистеин, А – любая алифатическая аминокислота (кроме аланина) и X - C-концевая аминокислота. Для проведения реакции присоединения пренильных групп , три С- концевые аминокислоты молекулы предшественника (AAX) удаляются, а цистеин активируется метилированием при участии S-аденозилметионина как донора метильной группы. Примерами пренлированных белков могут служить белки, связывающие и гидролизуюшие ГТФ (белок Ras и гамма субъединица трансдуцина связаны с фарнезилом) . Многочисленные G-белки участвующие в передаче сигналов имеют гаммасубъединицу, модифицированную геранил-геранилом.
Модификации белков, которые зависят от витамина C как кофактора, включают гидроксилирование пролина и лизина и амидирование С-концевой аминокислоты. Гидроксилирующие ферменты идентифицированы как пролил и лизил гидроксилазы. Донором амидной группы для амидирования С- концевой аминокислоты служит глицин.
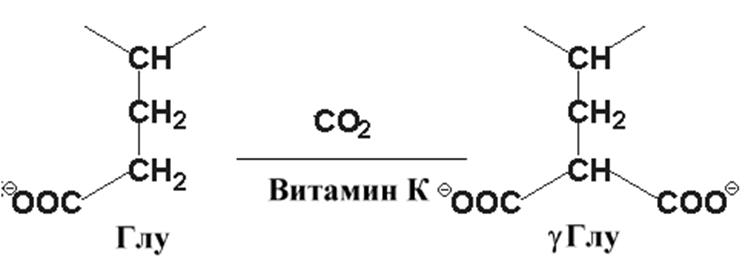
Витамин К – кофактор в карбоксилировании остатков ГЛУ. Результатом этой реакции является g-карбоксиглутаминовая кислота.
Это соединение важно для функции ряда белков, участвующих в свертывании крови. Образование g-глутамата позволяет белкам формировать комплексы с ионами кальция и таким образом способствовать изменению конформации и биологической активности белков. Антикоагулянты производные кумарина, варфарин и дикумарин, ингибируют реакцию карбоксилирования.
 |
Разные типы клеток многоклеточных организмов содержит одинаковый набор генов, но синтезируют разные наборы белков, обеспечивающих выполнение ими функций. Значительная часть этих белков одинакова для всех типов клеток. Они обеспечивают основные функции клеток (ферменты гликолиза, цикла Кребса, структурные белки и т.д). Скорость их образования и содержание в клетке обычно меняется незначительно. Такие белки получили название конститутивных белков. Конститутивными могут быть и специфические для клеток белки (например, гемоглобин в эритроцитах). Однако существуют белки, потребность в которых возникает только в специальных условиях. Такие белки обычно синтезируются с очень низкой скоростью, но синтез их может быть значительно ускорен. Например, при голодании или усиленных физических упражнениях клетки печени начинают активно превращать аминокислоты в глюкозу. Это становится возможным благодаря усилению синтеза ферментов, катализирующих образование глюкозы из аминокислот (тирозинаминотрансфераза и др.) . Если добавить лактозу в среду, на которой выращивается E. coli, и содержащую глицерол как единственный источник углерода , бактерии начинают синтезировать b -галактозидазу, фермент, который позволяет получить из лактозы глюкозу и галактозу и использовать их в качестве источников энергии. Белки, подобные тирозинаминотрансферазе и b -галактозидазе получили название индуцируемых белков. Не все клетки одинаково реагируют на один и тот же сигнал. Если клетки печени усиливали образование тирозин аминотрнасферазы, то тот же сигнал в клетках жировой ткани вызывал замедление синтеза этого фермента. Молекулярный механизм индукции ферментов был разработан Жакобом и Моно и известен как гипотеза оперона. Его механизм действия теперь хорошо установлен. Эти исследования были первыми в ряду исследований принципов и механизмов регуляции синтеза белков. Как и ожидалось, механизмы регуляции экспрессии генов (способности гена, производить биологически активный белок) у эукариот оказались значительно сложнее. Это связано и с особенностями строения клеток (у эукариот процессы транскрипции и трансляции пространственно разобщены благодаря ядерной мембране) и количественным и качественным набором регуляторов и т.д. Если у прокариот регуляция инициации транскрипции – основное место действия регуляторов, то у эукариот, регуляция экспрессии генов происходит на разных участках механизма синтеза белков, начиная от синтеза иРНК и до формирования пространственной структуры белков. У эукариот можно выделить несколько уровней такой регуляции:
1 Регуляция механизмов траскрипции.
2. Регуляция процессинга РНК
3. Регуляция транспорта РНК из ядра в цитозоль
4.Регуляция трансляции
5.Регуляция стабильности (продолжительности жизни) иРНК
6. Регуляция транспорта и функциональной активности белков.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.