Формирование конденсированного состояния происходит в процессе сближения атомов до некоторого необходимого минимального расстояния d0 (см. рис. 1.2.2), при котором вся система атомов будет иметь минимальную энергию U0. При этом конденсированное состояние может возникать в результате взаимодействия как электронейтральных атомов и молекул, так и через стадию их ионизации с последующим взаимодействием электростатического или обменного типа.
Кристаллы с ионным типом связи составляют подавляющее большинство среди материалов, с которыми имеют дело специалисты по производству керамики, вяжущих материалов, стекол и других неметаллических веществ, имеющих большое практическое значение. Это такие кристаллы, как СаО, MgO, FeO, MnS, ZrN ,CaF2, ZrO2 и другие. Наиболее распространенным примером при описании служит NaCl. Во всех случаях пространственная правильная или искаженная (аморфизированная) решетка состоит из рядов знакочередующихся ионов. При этом, в зависимости от типа решетки, каждый катион или анион может быть окружен 4,6,8 соседями противоположного по заряду знака.
Сущность той или иной химической технологии заключается в разрушении или перестройке тех или иных ионных связей, в переключении связей данного элемента на необходимый другой элемент.
При возникновении гетерополярных межатомных связей ионного типа обязательно наблюдается переход электронов от одних атомов к другим. Такие химические элементы, как F, О, N, Сl, имея незаполненную внешнюю электронную оболочку, сильно притягивают электроны с образованием либо отрицательных ионов, либо ковалентных связей. Для количественной характеристики этой способности элементов служит электроотрицательность, значение которой для некоторых широко распространенных в земной коре элементов приведена в табл. 1.3.1.
Таблица 1.3.1
Электроотрицательность некоторых элементов
|
H 2,1 |
|||||||
|
Li 0,97 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,1 |
O 3,5 |
F 4,1 |
|
|
Na 1,0 |
Mg 1,2 |
Al 1,5 |
Si 1,7 |
P 2,1 |
S 2,4 |
Cl 2,8 |
|
|
K 0,90 |
Ca 1,0 |
Ga 1,8 |
Ge 2,0 |
As 2,2 |
Se 2,5 |
Br 2,7 |
|
|
Rb 0,89 |
Sr 1,0 |
In 1,5 |
Sn 1,72 |
Sb 1,82 |
Te 2,0 |
I 2,2 |
|
|
Cs 0,86 |
Ba 0,97 |
Tl 1,4 |
Pb 1,5 |
Bi 1,7 |
Po 1,8 |
At 1,9 |
|
Для удобства пользования элементы располагают по электроотрицательности в возрастающий ряд. Применим этот прием, использовав из табл. 1.3.1 преимущественно элементы, широко применяемые в производстве конструкционных материалов. Элементы, имеющие одинаковую или очень близкую электроотрицательность, будем располагать в столбцах.
Элементы, являющиеся металлами, сравнительно легко ионизируются, отдавая электроны, и превращаются в катионы в соответствии с реакцией
Me Þ Меm+1+ mе - ,
где m - число удаленных или приобретенных электронов.
На отрыв электрона от атома требуется энергия, равная энергии ионизации 1, поглощение электрона элементом с высокой электроотрицательностью (в частности, галогенидами) сопровождается выделением энергии, которую называют электронным сродством А.
Таблица 1.3.2
Сродство элементов к электрону
![]() Активность в приобретении электронов
Активность в приобретении электронов
|
Cs Rb K Ba Na Mg Al Sn Ga Sb B H As S C Br Cl N O F |
|
Li Ca Y Pb Co Ni Si Ge P I |
|
Sr La-Lu Be Nb Pb Bi Te |
|
In W Cu |
|
Ti Cr |
![]() Легкость
потери электронов
Легкость
потери электронов
Шкалу электроотрицательности разработали химики, в частности табл. 1.3.2 близка к данным Полинга. Ею пользуются для качественных рассуждений о прочности связей. Если электроотрицательности двух элементов, которые образуют связь, сильно отличаются, то можно ожидать, что связь достаточно прочна и будет сопровождаться значительным разделением заряда и высокой степенью ионности
Энергия ионной связи пары ионов в кристалле может быть представлена в виде суммы
Uc = ½[A-I-R+V], (1.3.1)
где А - электронное сродство, I - энергия ионизации,R - энергия отталкивания, V - кулоновская сила притяжения.
Основной вклад в энергию притяжения ионов вносят кулоновская энергия притяжения и энергия электронного переноса.
Потенциал отталкивания, являющийся следствием действия запрета Паули на взаимодействие сближающихся электронных оболочек, быстро уменьшается с увеличением расстоянии между ионами и уже на равновесных расстояниях а0 вносит сравнительно небольшую долю в ионную энергию кристалла.
Например, для молекулы NaCl (по отношению к энергии свободных нейтральных атомов) при параметре a0 = 2,81Å, характерном для гранецентрированной кубической решетки каменной соли, получены следующие данные:
Электронное сродство хлора, А -3,75 эВ
Энергия ионизации натрия, I -5,14 эВ
Энергия электростатического куло-
новского притяжения - 8,86 эВ
Энергия отталкивания -1,02 эВ
Энергия связи по формуле (3.1) - 3,25 эВ
Экспериментально наблюдаемое
значение на 1 ион - 3,3 эВ
Для большинства молекул с ионным типом связи эта энергия может достигать 10 эВ.
Для определения энергии связи в кристалле, состоящем из взаимодействующих друг с другом молекул, воспользуемся потенциалом Маделунга (1.2.3)
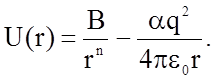
При формировании решетки взаимодействие каждого иона с его окружением, учитываемое константой Маделунга a, приводит к выстраиванию молекул таким образом, что расстояние между ионами станет равным параметру решетки а0. Например, в свободной молекуле NaCl расстояние между ионами составляет 2,36 Å, при объединении молекул в решетку оно возрастает до 2,81 Å.
В этом состоянии энергия системы Uc должна быть минимальной (см. рис. 1.2.2) и производная 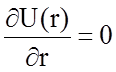 . Это позволяет исключить неизвестную пока константу В:
. Это позволяет исключить неизвестную пока константу В:
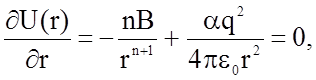
откуда получаем
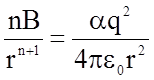 и
и 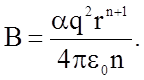
Подставляя значение В в формулу (1.2.3), получаем для энергии связи однозарядных ионов (m = 1), находящихся на расстоянии г = а0, равном параметру решетки кристаллов:
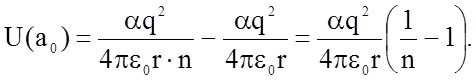 (1.3.2)
(1.3.2)
Если кристалл состоит из N молекул (или 2N ионов), то, учитывая q = e – заряду электрона, можно записать выражение для энергии связи
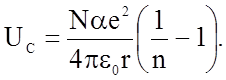 (1.3.3)
(1.3.3)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.