Значительные успехи достигнуты в последние десятилетия Коэном, Ашкрофтом, Харрисоном и другими исследователями за счет применения метода псевдопотенциала, изложение которого выходит за пределы нашего курса, но по которому уже имеется значительная литература. При этом широко используется применение в расчетных формулах эмпирических коэффициентов, определяемых опытным путем.
При определении энергии связи в металлах опираются на следующее основное предположение: на обобществленные электроны, находящиеся в объеме и обеспечивающие связь, действует поле, создаваемое ядрами и всеми другими электронами. Важную роль играют также кинетическая энергия электронов, энергия обменного взаимодействия валентных электронов с электронами, принадлежащими ионам остова и энергия корреляционного взаимодействия газа свободных электронов, учитывающая их спины. Так что в общем виде энергия связи металлических атомов в решетке полагается
Uс = - W + Wk – Ee – Ek, (1.3.4)
где энергия W включает в себя кулоновскую энергию Маделунга, потенциальную энергию ионов и косвенное взаимодействие "ион-электрон-ион"; Wk - кинетическая энергия облака валентных электронов, Eе - энергия обменного взаимодействия и Ek - поправка на корреляционное взаимодействие электронов.
Громоздкие и сложные вычисления энергии сцепления атомов дают более или менее хорошее согласие теории с экспериментом пока лишь для простых металлов. Например, опираясь на метод псевдопотенциала, Ашкрофт и Лангрет рассчитали энергию связи для ряда металлов (см. табл. 3.4). Расчет велся по полученной авторами формуле:
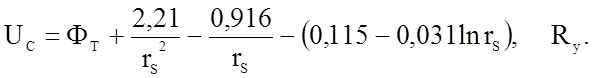 (1.3.5)
(1.3.5)
Здесь Фт соответствует W в формуле (1.3.4) и описывает ион-электрон-ион взаимодействие, включающее и энергию Маделунга, второй член представляет собой кинетическую энергию валентных электроновWk, третий член - это обменная энергия Ее , последний член описывает энергию корреляционного взаимодействия электронов, rs - среднее расстояние между валентными электронами, при расчетах используют величину r, подбираемую на основе измерений постоянной решетки а0.
В формуле (1.3.5) при определении коэффициентов использовалась внесистемная единица измерения энергии "ридберг" (1Ry = 13,6 эВ).
Таблица 1.3.5
Энергия связи и сжимаемость металлов
|
Элемент |
Отношение сжимаемостей К/К0* |
Uc, ридберг/ электрон |
DН0298 |
|||
|
Теория |
Экспе- римент |
Теория |
Экспе- римент |
кДж/моль |
Эв/ атом |
|
|
Al |
1,41 |
1,38 |
3,5 |
3,9 |
314 |
3,34 |
|
Pb |
1,55 |
1,79 |
3,2 |
3,5 |
196 |
2,04 |
|
Zn |
1,10 |
1,05 |
2,1 |
2,1 |
130,9 |
1,35 |
|
Mg |
0,86 |
0,89 |
2,1 |
1,9 |
147,4 |
1,53 |
|
Na |
0,45 |
0,46 |
1,6 |
1,5 |
108 |
1,13 |
|
K |
0,38 |
0,39 |
1,1 |
1,0 |
90 |
0,941 |
*K0= 1,7×rs5- сжимаемость свободных электронов; для определения энергии связи в единицах ридберг/ион, нужно умножить приведенную в табл. 1.3.5 величину Uc на валентность металла.
В табл. 1.3.5 приведены результаты численного расчета энергии связи для ряда металлов, здесь же приведены данные о сравнении теоретических и экспериментальных значений сжимаемости, часто применяемых для определения достоверности расчетов и получения необходимых параметров.
Таблица дополнена величиной DН0298, теплотой сублимации, ближе всего соответствующей величине энергии связи. Для металлов она изменяется в пределах от 61,3 кДж/моль у ртути до 845,3 кДж/моль у вольфрама .
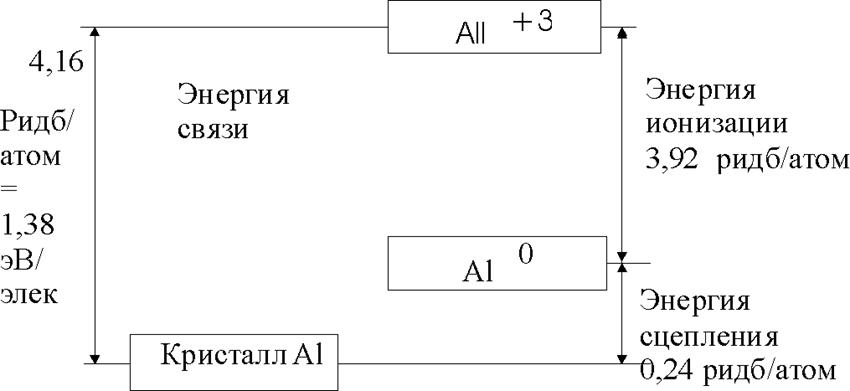
Очень часто при описании взаимодействия атомов в кристаллической решетке используют понятия "энергия связи", "энергия сцепления" и "энергия ионизации". Связь между ними проиллюстрирована на рис.1.3.5 для атомов алюминия.
 |
Расчет энергии связи для многообразия сплавов и элементов с примесями остается пока за пределами возможностей.
Поскольку металлическая связь не обладает направленностью, при образовании металлических кристаллов наблюдаются, как правило, эффекты максимально плотной упаковки. Координационное число К в первой сфере у 62 элементов составляет 8 или 12, у некоторых элементов (Ga, In, Tl), проявляющих металлические свойства, из-за недостатка валентных электронов межатомные связи имеют смешанный характер и структура резко отличается от обычных металлов.
Полуметаллические атомы As, Bi, Sb образуют гофрированные сложные структуры с координационным числом 3 в пределах слоя, причем расстояние между атомами внутри слоя всегда меньше, чем между атомами, находящимися в соседних слоях.
1.3.4. Водородная связь
Этот тип связи очень важен, так как именно он обеспечивает межмолекулярную связь воды в жидком и кристаллическом состояниях. Вода является необходимым компонентом всех биологических систем и при формировании в природе многих минералов. При производстве керамики, огнеупоров, строительных материалов и конструкций многие особенности технологии как раз определяются применением воды, ее воздействием на сырье и промежуточные материалы. Наконец, стойкость изделий в условиях взаимодействия с влагой атмосферы, растворение и коллоидообразование таких веществ, как соли, глины, известь определяются особыми свойствами воды.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.