где коэффициент А определяется видом взаимодействия, составляет около А » 10-77 Дж/м6 и при межмолекулярном расстоянии 0,3…0,4 нм обеспечивает энергию связи 0,2 эВ/молекулу » 6¸10 кДж/моль.
 Д и с п е р с и о н н о е в з а и м о д е й с т
в и е. Рассмотрим его на простом
примере, когда два атома гелия находятся достаточно близко друг к другу.
Распределение электронной плотности атома гелия (и волновая функция его
электронов) обладают сферической симметрией, вследствие чего электрический дипольный
момент его одноатомной молекулы равен нулю.
Д и с п е р с и о н н о е в з а и м о д е й с т
в и е. Рассмотрим его на простом
примере, когда два атома гелия находятся достаточно близко друг к другу.
Распределение электронной плотности атома гелия (и волновая функция его
электронов) обладают сферической симметрией, вследствие чего электрический дипольный
момент его одноатомной молекулы равен нулю.
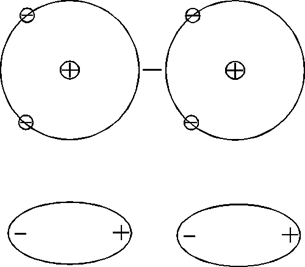
Рис.1.3.10. Образование и
притяжение мгновенных диполей в гелии, охлажденном ниже 272,3К
К
По крайней мере, равно нулю среднее значение электрического момента изолированного атома. Однако атом представляет собой динамическую систему, электроны вследствие своего движения создают мгновенные быстро меняющиеся диполи.
При сближении двух атомов вследствие взаимного влияния переменных электромагнитных полей в движении электронов устанавливается корреляция. В результате согласования молекулы установятся на некотором равновесном расстоянии друг от друга, причем энергия системы оказывается ниже и состояние устойчивей, если при этом расстоянии будет реализовываться некоторая сила притяжения. При этом мгновенные диполи образуют систему как на рис. 1.3.10.
В 1930 году Ф.Лондон провел расчет величин сил и энергии дисперсионного взаимодействия и получил соотношение
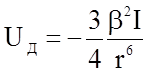 , (1.3.9)
, (1.3.9)
где b - поляризуемость атома, коэффициент в выражении для дипольного момента атома р =e0bЕ, Е - напряженность электрического поля, создаваемого приближающимся атомом, I - энергия возбуждения атомов, например, для водорода I = 10,4 эВ, г - расстояние методу атомами.
Дисперсионные силы являются универсальными, действующими между любыми атомами, ионами и молекулами, если расстояние между ними еще подчиняется соотношению г >> d , где d - эффективный диаметр молекул. Для инертных газов (Не, Nе, Аг, Кг, ...) эти силы являются единственным типом сил притяжения. Их название связано с единством причины - поляризуемости атомов - для образования конденсированного состояния и оптического свойства - дисперсии света.
Для дисперсионного взаимодействия молекул, не обладающих сферической симметрией, вид формулы, описывающей энергию взаимодействия, усложняется, однако общий вид ее (1.3.9) остается неизменным.
О р и е н т а ц и о н н о е в з а и м о д е й с т в и е. Если взаимодействующие молекулы полярны, т.е. обладают собственным постоянным дипольным моментом р, то при уменьшении теплового движения электростатическое междипольное взаимодействие приводит к упорядочению в их расположении, при этом энергия системы уменьшится (рис.1.3.11).
Выстраиванию молекул противодействует их тепловое движение. Как показал ученик Ван-дер-Ваальса Кеезом (1912 г.), при достаточно высоких температурах, когда энергия взаимодействия двух диполей Uдип<<kT - энергии тепловых колебаний (k - постоянная Больцмана), энергия ориентационного взаимодействия подчиняется соотношению, близкому (1.3.9):
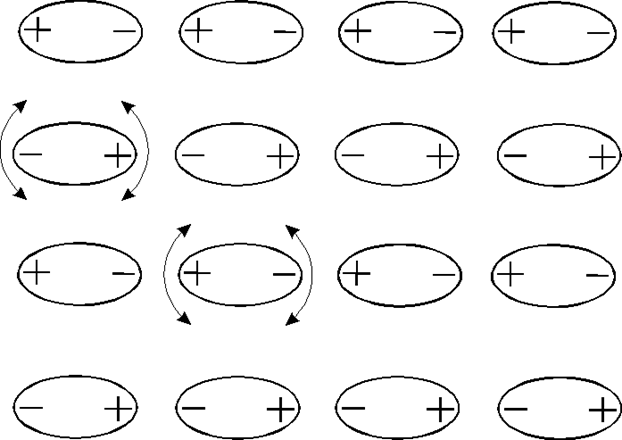 |
Рис.1.3.11. Выстраивание полярных молекул за счет диполь-дипольного ориентационного взаимодействия. Стрелками показаны тепловые колебания некоторых молекул, хотя колеблются все молекулы
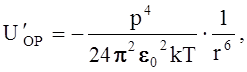 (1.3.10)
(1.3.10)
p=ql - дипольный момент пары ионов с зарядом q, находящихся на расстоянии l .
При низких температура Uдип>>kT , если взаимодействуют молекулы одного сорта и они полностью выстроены. В этом случае энергия взаимодействия достаточно точно описывается уравнением
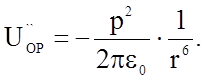 (1.3.11)
(1.3.11)
И н д у к ц и о н н о е в з а и м о д е й с т в и е. Индукционные силы притяжения также имеют электростатическую природу. У молекул, обладающих высокой поляризуемостью a , может возникнуть наведенный (индуцированный) дипольный момент под действием электрического поля приближающейся другой молекулы. Дальнейшее притяжение возникших диполей приводит к формированию кристаллической решетки с параметром а0>>d0 - диаметров взаимодействующих молекул (рис. 1.3.12).
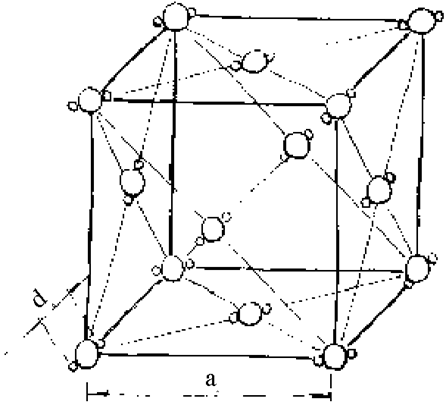
Рис. 1.3.12. Гранецентрированная кубическая решетка молекулярных кристаллов углекислого газа СO2
Теорию этого эффекта впервые развил Дебай (1920 г.). Он установил, что взаимодействие диполей характеризуется энергией связи, представленной уравнением (1.3.12)
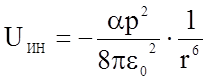 (1.3.12)
(1.3.12)
и не зависит от температуры.
Иначе такое взаимодействие называется деформационным, так как поляризация молекул сопровождается некоторой деформацией их электронных орбиталей.
В чистом виде эти три вида взаимодействия осуществляются редко, чаще при сближении молекул могут возникнуть в различных пропорциях все три вида связи. Полную энергию связи, обеспечиваемую силами Ван-дер-Ваальса, можно записать в виде
UВ-д-В = Uд + Uор + Uин. (1.3.13)
В табл. 1.3.6 приведены некоторые данные для кристаллов с молекулярными связями, в процентах вычислена доля энергии, приходящаяся на различные виды взаимодействия.
Видно, что у полярных молекул (Н2О) на 3/4 полная энергия состоит из ориентационного взаимодействия жестких диполей. У неполярных молекул преобладающую часть составляет энергия дисперсионного взаимодействия.
Таблица 1.3.6
Энергия связи молекулярных кристаллов и ее распределение по различным видам взаимодействия (в % от общей энергии)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.