|
Вещество |
Вид взаимодействия |
||
|
Дисперсионное |
Индукционное |
Ориентационное |
|
|
H2O |
19 |
4 |
77 |
|
NH3 |
50 |
5 |
45 |
|
HCl |
81 |
4 |
15 |
|
CO |
100 |
- |
- |
Следует отметить, что силы Ван-дер-Ваальса являются существенными не только при образовании твердого состояния у нейтральных атомов и молекул. Именно эти силы обеспечивают и сцепление частичек грунтов, и адгезию (прилипание) окисных пленок к поверхности металла, и обволакивание свежесколотых поверхностей пленкой мономолекулярной толщины из газов и паров атмосферы. Последний процесс происходит очень быстро, при атмосферном давлении и комнатной температуре - за доли секунды. Эти пленки прочно удерживаются даже неокисленной поверхностью и могут быть удалены лишь в вакууме путем прогрева и бомбардировкой ионами инертных газов.
1.3.6. Смешанные типы связей
Следует признать, что в отношении подавляющего большинства применяемых человечеством материалов строгое деление их по типам связей невозможно. Хотя ранее и были выделены 4 основных типа связей: Ван-дер-Ваальса, ионная, ковалентная и металлическая, - в чистом виде такие связи встречаются весьма редко. Новые классы веществ типа халькогенидов, которые характеризуются разнообразием типов связей, по своим свойствам, в зависимости от химического состава или искусственно создаваемой структуры, занимают широкий диапазон, например, от диэлектриков до проводников. Сюда относятся некоторые интерметаллиды и органические соединения, сложные интерколированные структуры на основе дихалькогенидных соединений TaTe2, МoТе2, РbТе2, имеющие сложную структуру, причем между слоями дихалькогенида располагаются тонкие слои органических соединений.
Смешанные и переходные типы межатомных связей весьма характерны для двух-, трех и многоатомных и многофазных соединений
На рис. 1.3.13 сочетание основных и промежуточных типов связей изображено схематически для некоторых элементов и соединений. Угловая точка соответствует 100% основной связи.
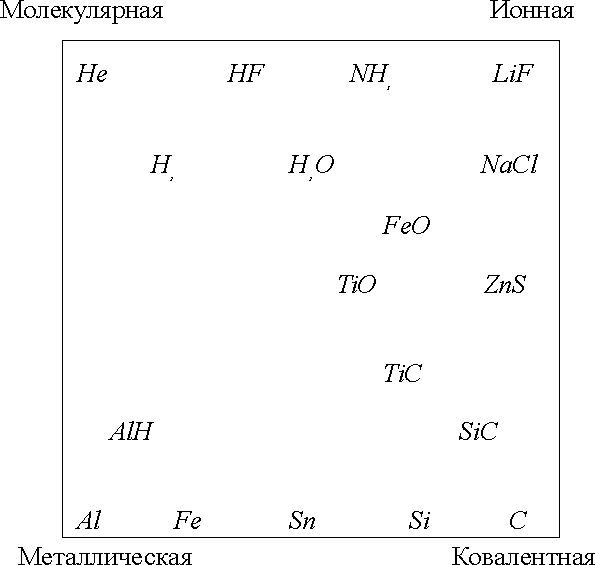 |
Рис. 1.3.13. Основные и промежуточные межатомные связи
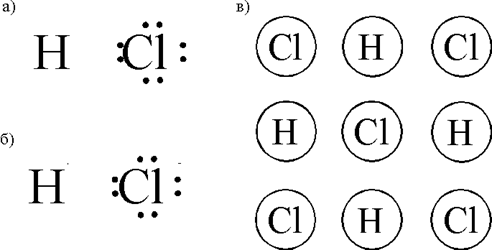
Рис.1.3.14. Связи в молекуле и между молекулами HCl в газе (а), в водном растворе (б), в твердом теле
Так молекулы HCl (рис. 1.3.14) в газовой фазе характеризуются ковалентным типом связи, в водном растворе в них преобладает ионный тип связи, а в твердом - ван-дер-ваальсовы связи.
Нагревание Si и Ge переводит их из соединений ковалентного типа в соединение, близкое к металлическому.
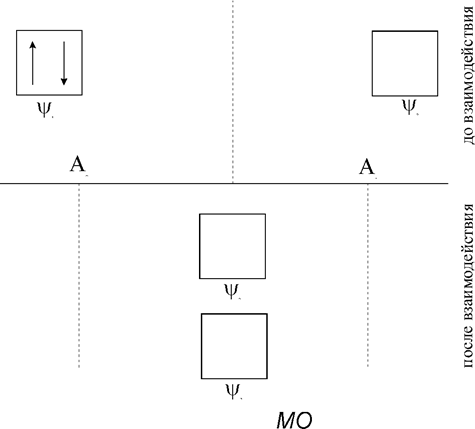 |
Рис.1.3.15. Возникновение координационной связи
В ряде случаев для объяснения свойств соединений мостикового типа, например, NH3×BF3, Al2Cl6, цепочечных соединений типа BaCl2 и других привлекаются представления о так называемой координационной связи. Ее отличие от ковалентной связи заключается лишь в том, что, если при ковалентной связи каждый атом поставляет в каждую связь по одному электрону, в результате чего образуются общие электронные пары с противоположной ориентацией спинов, - то в координационной связи оба электрона первоначально принадлежат атомной орбитали (А0) одного атома (донора а).
В различных веществах, склонных к комплексообразованиям, сольватации, гидратации и т.п. - устойчивость обязана многоцентровым связям. Вообще точного определения комплексных соединений на сегодняшний день нет. Г.В.Бокий предлагает называть комплексными соединения, в которых:
1) всегда имеются группы атомов, внутри которых связь более тесная, чем с другими атомами; эти группы называют комплексами и в структурных формах помещают в квадратные скобки;
2) в комплексе атомы группируются вокруг некоторого атома, называемого комплексообразующим или центральным, атомную группу, связанную с центральным атомом, называют лигандом, а многоцентровую связь часто называют лигандной;
3) центральный атом является атомом металла, как правило, с большой валентностью. Комплекс-лиганд по электрическому заряду может быть положительным, отрицательным или нейтральным. В последнем случае связь между комплексами может осуществляться как у молекулярных кристаллов.
Классифицируют комплексные соединения обычно по координационному числу Z и по форме комплекса, Z может изменяться от 2 до 8, но чаще всего равно 6, что соответствует образованию многогранника-октаэдра, образованного из лигандных групп.
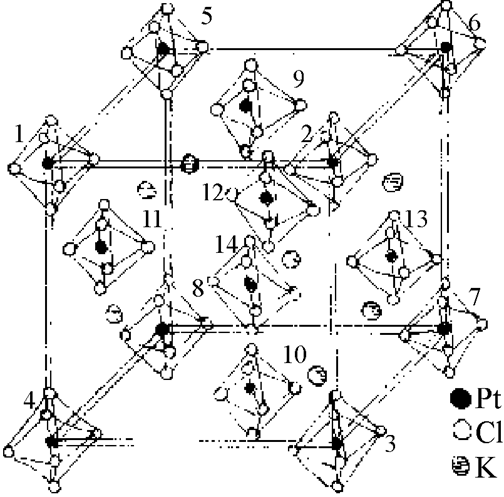
Например, в структуре K2[PtCl6] (рис.1.3.16) в состав комплекса-лиганда входят ковалентно связанные атомы Pt и 6 атомов хлора. Связь между комплексами осуществляется за счет ионных связей через калий.
 |
При теоретическом рассмотрении лигандных связей предпочтение отдают методу молекулярных орбиталей (МО). При этом учитывают, что для металлических атомов, являющихся центрами комплексов, характерно расщепление d - (или f) - уровней за счет электростатического поля лигандов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.