Рис.1.3.1. Кристалл NaCl
Экспериментально определенная из опытов по сжимаемости кристаллов величина n = 3,4 для NaCl. В качестве N обычно берут NA - число Авогадро и получают энергию связи на моль.
Константа Маделунга a учитывает то обстоятельство, что каждый ион связан в решетке с окружающими ионами I и II координационных сфер (рис.1.3.1). Иногда для уточнения рассматривают и другие взаимодействия, однако на величине Uc они сказываются мало. Константа Маделунга изменяется в пределах 1,6<a< 1,8 и вообще определяется кристаллической структурой.
В табл. 1.3.3 приведены экспериментальные значения энергии связи Uc и значения, вычисленные теоретически для 1 моля решетки, а также некоторые другие сведения об ионных кристаллах.
Таблица 1.3.3
Некоторые сведения о кристаллах с ионным типом связей
|
Вещество |
Параметр решетки |
Константа Маделунга |
Uc, Дж/моль |
Температура плавления, 0 С |
|
|
Теорет. значение |
Эксперим. значение |
||||
|
NaCl |
2,81 |
1,748 |
183,1 |
182,8 |
800 |
|
LiCl |
2,56 |
1,748 |
199,2 |
198,1 |
614 |
|
KCl |
3,14 |
1,748 |
165,4 |
164,4 |
770 |
|
KBr2 |
2,80 |
1,748 |
159,3 |
156,2 |
735 |
|
CsI |
2,28 |
1,763 |
139,1 |
145,3 |
621 |
|
AgCl |
2,78 |
1,748 |
203 |
205,7 |
455 |
|
CuCl |
2,71 |
1,638 |
216 |
221,9 |
430 |
|
BeO |
1,64 |
1,641 |
- |
4521; 4601 |
2520… 2570 |
|
CaF2 |
2,38 |
- |
- |
2613,3 |
1418 |
|
TiO2 |
- |
1,600 |
- |
12158,5 |
1870±15 |
|
CaO |
2,4 |
- |
- |
3572 |
2600 |
|
MgO |
2,10 |
- |
- |
3935,6 |
2800 |
В справочной литературе иногда в качестве параметра решетки приводят величину r = a0, равную кратчайшему расстоянию между двумя идентичными ионами одного знака.
Устойчивость межмолекулярных связей в некоторой мере характеризует температура плавления вещества. У ионных кристаллов она довольно высока (см. табл. 1.3.3), наивысшие температуры плавления у следующих окислов, 0C: ZrO- 2900; HfO - 2780±30; ThO2 - 3050.
Следует отметить, что наблюдается неплохое соответствие теоретических и экспериментальных значений, но только для кристаллов галогенидов щелочных металлов.
Значительно хуже соответствие теоретических и экспериментальных результатов для кристаллов с валентностью более 1. Причина заключается в кулоновском характере сил притяжения. Сферическая симметрия электростатического поля ионов приводит к отсутствию избирательности и стремлению каждого иона окружить себя возможно большим числом соседей противоположного знака. Ионы располагаются по принципу наиболее плотной упаковки. Координационное число К и тип структуры зависят от радиусов взаимодействующих ионов. Так, вокруг очень маленького иона натрия размещаются 6 ионов хлора большего радиуса (К=6) .
Чтобы было выполнено условие электронейтральности, вокруг иона хлора располагаются также 6 ионов натрия (см. рис. 1.3.1). В кристалле хлористого цезия оба иона сравнимы по величине и поэтому ион цезия размещается в центре октаэдрической поры, в центре куба, в вершинах которого размещены ионы хлора (рис. 1.3.2).
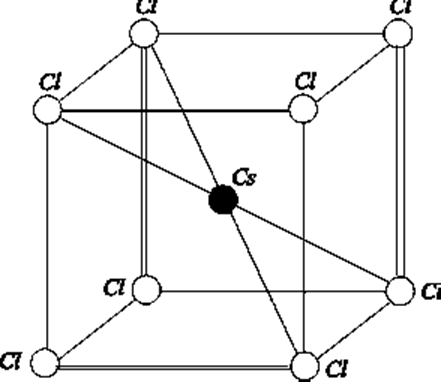
Рис. 1.3.2. Элементарная ячейка решетки CsCl
Таким образом, в определении типа структуры большую роль играют геометрические соотношения.
При взаимодействии двухвалентных ионов сферическая симметрия электростатического поля ионов нарушается, и это резко ухудшает применимость потенциалов Маделунга и Борна-Майера для расчета энергии связи.
1.3.2. Ковалентная связь (гомеополярная)
Резкое разграничение ионной и ковалентной, а также ковалентной и металлической связей неоправданно. Условность этого разделения подчеркивается следующими фактами: энергия связи в этих кристаллах близка и составляет порядка 10 эВ на атом, температуры плавления и кипения отличаются мало (менее, чем в 10 раз); близки во многих случаях механические свойства - твердость, пластичность, прочность. Наконец, в основе микромеханизма их возникновения лежат отторжение и обобществление электронов, имеющие в каждом конкретном случае лишь некоторые особенности.
В ионной связи в результате взаимодействия возникает ситуация, когда электрон, обеспечивающий связь, принадлежит одному (отрицательному) иону более, чем другому. В случае ковалентной связи происходит спаривание электронов у соседних атомов, образующих кристаллическую или аморфную конденсированную структуру.
Классическими примерами кристаллов с ковалентной связью служат элементы IV группы периодической таблицы: С, Si и Ge, а также многие их соединения, в частности, широко распространенный в практике керамического производства карбид кремния SiС. Полностью или частично ковалентный характер имеют связи кремния во многих силикатах. Ковалентная связь преобладает также в кристаллах типа АNB8-N, т.е. в кристаллах, образованных из элементов А и В, атомы которых содержат N и (8 -N) валентных электронов соответственно, так что на одну пару взаимодействующих атомов приходится восемь s-p электронов валентных орбиталей. Однако в этом случае межатомная связь включает в себя как ковалентную, так и ионную составляющую.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.