 |
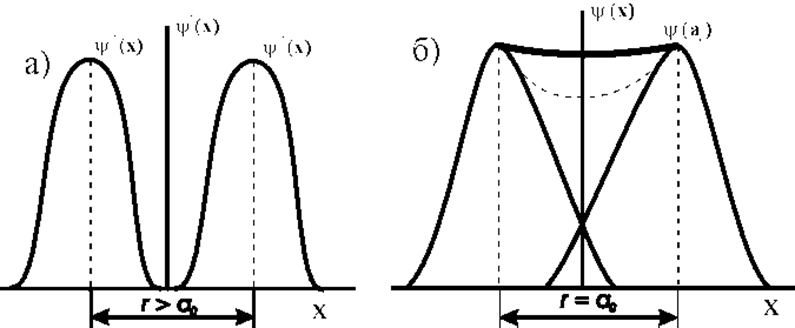
Выше в пункте 1.2.3 на примере молекулы H2 были рассмотрены принципы возникновения ковалентной связи. Основным признаком ковалентной связи между атомами является наличие между этими атомами электронов с антипараллельными спинами. Феноменологически возникновение этой связи можно пояснить рис. 1.3.3.
При сближении атомов происходит заметное перекрытие электронных оболочек и резко возрастает частота обмена электронами. Вычислено, что для водорода при r»2Å частота обмена возрастает до 1014 с-1, т.е. практически одинакова с частотой вращения в изолированном атоме. Следовательно, пара электронов в связи обобществляется, электроны разных, но взаимодействующих атомов, - становятся неразличимы, вероятность их обнаружения на линии, соединяющей атомы, наибольшая.
Вот это появление состояния с повышенной электронной плотностью в некоторых направлениях межъядерного пространства, снижающее энергию системы, и приводит к возникновению межатомных сил притяжения ковалентного типа. Различают ковалентные s-, p-, d - связи.
s-связь образуется вследствие перекрытия атомно-электронных орбиталей вдоль линии связи. Для элементов IV группы - это гибридные sp3 связи, наиболее жесткие и прочные вследствие наибольшего перекрытия орбиталей.
p - связи образуются вследствие sp2-гибридизации, что в атомах углерода, например, оставляет по одному неспаренному p-электрону. В результате возникают три связи под углами по 1200 в одной плоскости и существенно более слабая p-связь, перпендикулярная этой плоскости, что и приводит к структуре типа графита.
Еще слабее d -связь, возникающая вследствие взаимодействия d -электронов.
 В природе очень
распространены вещества со смешанными или гибридными связями, когда в пределах
одного вещества можно обнаружить связи различного типа.
В природе очень
распространены вещества со смешанными или гибридными связями, когда в пределах
одного вещества можно обнаружить связи различного типа.
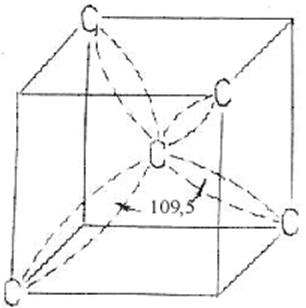
Ковалентная связь имеет характерную черту - сильную пространственную направленность. В частности, углерод, кремний и германий имеют структуру типа алмаза с равномерно распределенными в пространстве связями. Каждый атом, например, атом углерода в алмазной фазе, образует с четырьмя соседними атомами углерода одинаковые тетраэдрические углы по 109,50 (рис. 1.3.4).
Рис. 1.3.4. Тетраэдрическое расположение атомов углерода в алмазной решетке
Такова же величина угла связей и у СН4,ССl4, Si, SiF, SiC, а также других аналогичных соединений.
Если один из пяти атомов заменен (например, в хлористом метиле один атом водорода заменен хлором), то углы связей искажаются, что приводит к возникновению у таких молекул дипольного электрического момента.
В тех случаях, когда ковалентный кристалл образован атомами одного типа (C, Si, Ge ), все межатомные связи внутри кристалла являются равноправными и поэтому весь кристалл представляет собой единую многоатомную молекулу. Ковалентная связь обладает свойством насыщаемости, т.е. каждый атом может образовывать связи лишь с конечным числом атомов (С, Si, Ge - с четырьмя), атомы второй координационной сферы (К = 12) он "не чувствует". Кристаллы этого типа обладают наивысшей энергией связи (табл. 1.3.4).
Кристаллы этого типа обладают рекордной твердостью, хотя и хрупки. Чисто ковалентная связь свойственна лишь кристаллам некоторых чистых элементов (C, Si, Ge), однако уже SiC характеризуется степенью ионности связи 0,18.
Таблица 1.3.4
Данные об энергии связи в ковалентных кристаллах
|
Кристалл |
UC, МДж/моль |
|
С (алмаз) |
680 |
|
Si |
440 |
|
Ge |
370 |
|
SiC |
800 |
Металлическую связь, наряду с ионной и ковалентной, в силу ее значительной прочности (от 1 до 5 эВ на атом) в ряде случаев называют первичной связью, подчеркивая тем их преимущество перед более слабыми ван-дер-ваальсовскими и водородными связями.
Можно рассматривать металлическую связь как занимающую промежуточное положение между ионной и ковалентной. С одной стороны, при металлической межатомной связи происходит обобществление валентных электронов, как и при ковалентной связи. С другой стороны, в конечном итоге положительные ионы остова решетки удерживаются вместе отрицательными электронами, что дает возможность сопоставить металлические кристаллы и аморфные металлические стекла с веществами с ионной связью. Высокая концентрация и высокая подвижность электронов в металлических решетках оправдывает применение к ним таких понятий, как "электронный газ" и "электронное облако".
До создания квантовой механики (до 1926 г.) не было даже описательного или качественного объяснения металлической связи. Высокая электро- и теплопроводность металлов объяснялась на основании представлений классической теории Друде-Лорентца (1900 г.), в соответствии с которой кристалл металла можно рассматривать как резервуар, заполненный газом свободных электронов. Причем классическая теория давала качественно верные ответы.
Лишь начиная с 1926 г. появился ряд теорий увеличивающейся полноты и сложности, которые привели к должному пониманию природы металлической связи, хотя о существовании точной количественной теории металлической связи говорить преждевременно. Наибольший вклад в развитие взглядов на взаимодействие металлических атомов принадлежит Ферми, Зоммерфельду, Дираку, Блоху, Вигнеру, Зейтцу, Бриллюэну.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.