1. ОСНОВНІ ХАРАКТЕРИСТИКИ ЯКОСТІ ВОДИ
Домішки, що містяться у воді, можуть бути класифіковані за різними кри- теріями: за фізичним станом (розчинені, колоїдні, нерозчинені), за походжен- ням (органічні, мінеральні, мікроорганізми).
Якість природної води характеризується фізико-хімічними властивостями і бактерійними забрудненнями.
Фізичні властивості (органолептичні) – температура, каламутність (або прозорість), кольоровість, смак і присмак, запах.
Хімічні властивості обумовлюються вмістом у воді розчинених хімічних речовин. До цієї групи відносять сухий залишок, твердість, окислюваність, ак- тивна реакція, вміст заліза, марганцю, сполук кремнію, хлоридів, сульфатів, фтору, йоду та ін.
Бактерійне і вірусне забруднення води оцінюють за допомогою показників колі-індекс, колі-тітр, загальне мікробне число.
У відкритих водоймищах містяться також різноманітні дрібні рослинні й тваринні організми, що знаходяться у завислому стані (планктон) або прикріп- лені до дна водоймища (бентос). Рослинний планктон називається фітопланк-
тоном, тваринний - зоопланктоном; бентос називають відповідно фитобенто-
сом і зообентосом.
Перевірка придатності води для питних цілей і вибір відповідних методів обробки можуть бути здійснені при наявності повного аналізу води з визначенням таких показників: завислі речовини, сухий залишок, рН, кольоровість, оки- слюваність, вільна вуглекислота, лужність, твердість загальна, твердість кар- бонатна, вміст основних катіонів і аніонів. Залежно від виду джерела водопостачання потрібно мати кілька аналізів, що характеризують вихідну воду. При цьому необхідно переконатися в правильності аналізу води.
Вода електронейтральна, тому суми концентрацій катіонів і аніонів, виражені в мг-екв/дм3, мають бути рівні:
Σ К = Σ А (1.1)
⎡Са 2 + ⎤ + ⎡Mg 2 + ⎤ + ⎡Na + ⎤ + ⎡Fe 2 + ⎤ = ⎡HCO − ⎤ + ⎡SO 2 − ⎤ + ⎡Cl − ⎤ + ⎡SiO 2 − ⎤ .
3 4 3
Для перерахування концентрацій іонів, виражених у мг/дм3, у мг-екв/дм3, концентрацію треба розділити на еквівалентну масу даної речовини:
Ca 2 +
20,04
Mg 2 +
+
12,16
Na +
+
23
Fe3 +
+
27
HCO −
= 3
61,02
SO 2 −
+ 4
48,03
Cl −
+ +
35,48
SiO 2 −
3
38
72 + 49 + 21 + 0,2 = 147 + 179 + 64 + 23
20,04
12,16 23 27
61,02
48,03
35,48 38
3,593 + 4,029 + 0,913 + 0,007 = 2,409 + 3,727 + 1,804 + 0,605
8,542 = 8,545.
Основною перевіркою правильності аналізу є зіставлення сум концентра- цій (у мг-екв/дм3) катіонів і аніонів, при цьому повинна виконуватися нерів- ність
води:
ΣК − ΣА⋅100% ≤ 5% .
ΣК + ΣА
8,542 − 8,545 ⋅100% < 5%.
8,542 + 8,545
Сумарна концентрація катіонів Са2+ і Mg2+ визначає загальну твердість
2 +
вих
Ca 2 +
Mg
72
49
7,62 3
Т з =
20,04
+
12,16
= + =
20,04 12,16
мг-екв/дм . (1.2)
Знаходимо карбонатну твердість:
−
HCO
![]() Т = 3
Т = 3
61,02
= 147 = 2,41 мг-екв/дм3. (1.3)
61,02
Визначаємо некарбонатну твердість:
![]() Тнк = Т вих − Тк = 7,62 − 2,41 = 5,21 мг-екв/дм3. (1.4)
Тнк = Т вих − Тк = 7,62 − 2,41 = 5,21 мг-екв/дм3. (1.4)
Мінеральний залишок:
Р = Σ К + Σ А = 72 + 49 + 21 + 0,2 + 147 + 179 + 64 + 23 = 481,7 мг/дм3.
2
Результати аналізу іонного складу води зручно зобразити графічно як діа-
граму (рис. 1.1), яку будують у вигляді трьох рівної довжини рівнобіжних смуг, що примикають одна до одної.
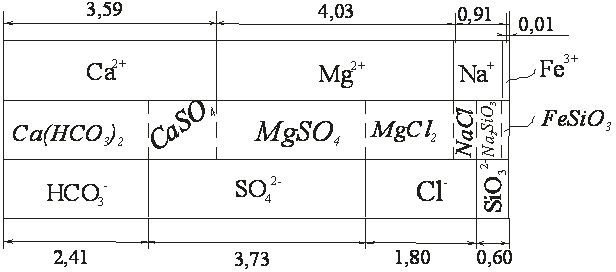
Рис. 1.1 – Діаграма передбачуваного складу солей у вихідній воді за даними аналізу
На верхній смузі ліворуч праворуч – відповідно концентрації у визначе- ному масштабі розташовують катіони, що містяться у воді, у порядку зростання основних властивостей, на нижній смузі у тому ж масштабі ліворуч праворуч – аніони в порядку зростання основних властивостей. На середній смузі зі сполу- чень катіонів і аніонів визначають передбачуваний склад солей. Масштаб для середньої смуги вдвічі менше, ніж для верхньої і нижньої.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.