· детекции и мониторирования минимальной резидуальной болезни (MRD).
Диагностические возможности проточной цитометрии
А. Использование проточной цитометрии для количественной оценки популяций и субпопуляций лимфоцитов
Открытие в 1975 г. гибридомной технологии получения МКА предоставило возможность изучить иммунологические маркеры клеток, охарактеризовать их фенотип по набору поверхностных антигенов и рецепторов, строго специфичных для определенной клеточной линии. В 1982 г. в Париже проведено I Рабочее совещание по созданию единой номенклатуры МКА, на котором МКА со сходной специфичностью были объединены в группы (кластеры). Первоначальное значение понятия «кластер дифференцировки» (CD) подразумевал набор МКА, распознающих одну и ту же антигенную структуру на поверхности клеток. Со временем термин “кластер дифференцировки” стал означать саму структуру на клеточной поверхности. В настоящее время с помощью МКА идентифицировано около 166 поверхностных антигенов лейкоцитов [см. приложение N 19]. В большинстве случаев определена их молекулярная масса, химическая структура, функция [1, 9, 12].
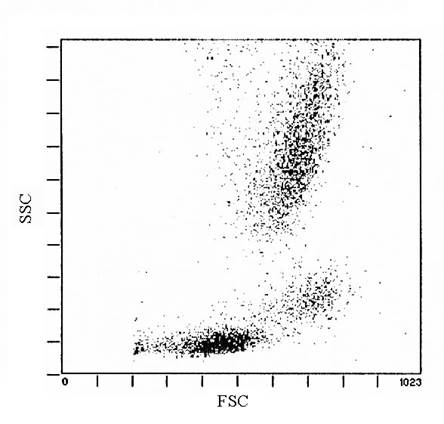 |
В основе работы проточного цитометра лежит одновременное разделение лейкоцитов на три популяции – лимфоциты, моноциты и гранулоциты – на основании измерения сигналов светорассеивания под малым (1-100) и большим углами, и измерение интенсивности флюоресценции изучаемых клеток, меченных специфическими МКА.
Рис. 2. Распределение на три популяции. (внизу – лимфоциты, в средней части графика – моноциты, вверху – нейтрофилы).
Как, уже говорилось выше, сигналы светорассеяния, характеризующие размер клетки (FSC), а также цитоплазматические и мембранные особенности (SSC) привязывают флюоресцентный анализ к морфологически определенным популяциям. В соответствии с этим ( рис. 2) лимфоциты, имеющие небольшие сигналы переднего и бокового светорассеивания располагаются в нижней части графика, моноциты несколько выше правее, так как для них характерны средние значения этих показателей, нейтрофилы, в свою очередь, располагаются в верхней части графика, так для них характерны высокие сигналы вышеназванных показателей.
Субпопуляционный анализ лимфоцитов может быть проведен с помощью МКА, меченных различными флуорохромами. В связи с этим необходимо осветить ряд вопросов, связанных с выбором флуорохромов и процедурой окрашивания суспензии исследуемых клеток МКА.
Выбор флуорохрома и процедура окрашивания
Выбор флуорохрома зависит от многих факторов, в частности от того, какой флуорохром способен регистрировать имеющийся проточный цитометр. Идеальный флуорохром должен обладать следующими свойствами:
· - возбуждаться при нужной длине волны;
· - легко связываться с белками;
· - обладать низким уровнем неспецифического связывания (окрашивания);
· - его излучение должно лежать в диапазоне максимальной чувствительности фотодетектора;
· - длины волн излучаемого при его флюоресценции света не должны совпадать с длинами волн «аутофлюоресценции» (флюоресценция молекул, присутствующих в анализируемых клетках, но не имеющих отношения к флуорохрому);
· - должна существовать возможность использования данного флуорохрома одновременно с другими флуорохромами в одном опыте.
Таким образом, идеальный флуорохром должен быть удобен при использовании, давать легко детектируемый и отличный от фона сигнал и позволять применение одновременно с ним других флуорохромов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.