ОСНОВНЫЕ ПРИНЦИПЫ И ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ
ПРОТОЧНОЙ ЦИТОМЕТРИИ В КЛИНИЧЕСКОЙ ИММУНОЛОГИИ И ЭНДОКРИНОЛОГИИ
Достижения в разработке проточно-цитометрического оборудования и компьютеризированных методов обработки данных позволили создать новое поколение проточных цитометров, широко применяемых в клинической лабораторной практике. Проточная цитометрия прочно внедрилась в таких областях медицины как иммунология, гематология, инфекционные болезни, трансплантационный мониторинг, онкология и генетика. Упрощение конструкции лазера, успехи химии флуорохромов, достижения в области продукции и стандартизации моноклональных антител (МКА) позволили сделать сложные коррелятивные измерения нормальных и неопластических клеток клинической практикой [20, 21]. Сегодня проточно-цитометрический анализ позволяет патологу с высокой степенью эффективности диагносцировать, прогнозировать и проводить мониторинг в ходе заболевания. В методических разработках представлены основные принципы и диагностические возможности использования проточной цитометрии в диагностической иммуногематологической лаборатории. Дана характеристика основных дифференцировочных маркеров Т- и В-лимфоцитов, макрофагов/моноцитов, натуральных киллеров, показана клиническая значимость определения CD-маркеров.
Основные принципы иммуноцитометрии
Общие принципы проточной цитометрии включают в себя проведение оптических и флюоресцентных измерений отдельных клеток (или какой-либо "биологической частицы", включая изолированное ядро, хромосомные препараты или микробиологические организмы) в жидком световом потоке, во время их прохождения отдельным рядом через монохроматичный свет, обычно продуцируемый лазером. В этом случае физические свойства клеток, такие как размер или цитоплазматическая гранулярность, могут быть измерены на какой-нибудь отдельной неокрашенной клетке. Клетки также могут быть помечены специфическими красителями, окрашивающими ДНК, РНК или белок, или целым набором флюрохром-коньюгированных антител, направленных к мембранным и внутриклеточным компонентам клеток. После окрашивания флюоресцирующими маркерами монодисперсная суспензия клеток, с целью, анализа помещается в контейнер для проб проточного цитометра и под давлением впрыскивается в центр быстродвижущегося в том же направлении потока жидкости через специально разработанный наконечник, в результате чего скорость движения клеток резко возрастает и они выстраиваются, образуя столбик, окруженный оболочечной жидкостью. Геометрия наконечника позволяет создать условия ламинарного потока струи образца, в результате чего не происходит перемешивания суспензии исследуемых клеток с обтекающей жидкостью. Попадая в дальнейшем в измерительную камеру прибора, клетки поочередно пересекаются лучом лазера и возбуждаются светом определенной длины волны. В свою очередь, клетки посылают световые сигналы другой длины волны, которые, проходя через систему оптических линз, фильтров, двухцветных зеркал, регистрируются фотоэлектронным умножителем, преобразующим эти световые сигналы в электрические, обрабатываемые компьютером. Два или три флюоресцентных сигнала, каждый из которых сообщает о реакции одного МКА со специфически распознаваемым антигеном могут быть собраны с клеток вместе с сигналами переднего (FSC-forward scatter) и бокового светорассеяния (SSC-side scatter). Сигналы светорассеяния, характеризующие размер клетки (FSC), а также цитоплазматические и мембранные особенности (SSC) привязывают флюоресцентный анализ к морфологически определенным популяциям. Полученные данные могут быть записаны, проанализированы и представлены в виде гистограмм. При этом в случае одномерной гистограммы на оси абсцисс откладываетя интенсивность флюоресценции клеток, а по оси ординат число клеток с определенной интенсивностью
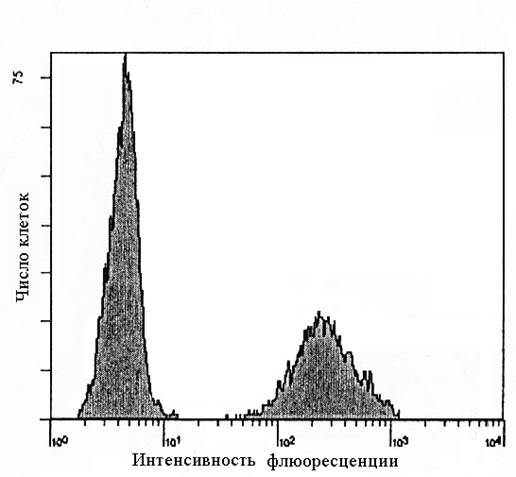 |
Рис. 1. Одномерная гистограмма. Слева – неокрашенные клетки (собственная флуоресценция или аутофлуоресценция клеток), справа – клетки, окрашенные МКА к миелопероксидазе (Anti-MPO/FITC).
Основная задача иммуноцитометрии
Основной задачей проточной цитометрии является определение состава популяции по маркерам клеточной поверхности (фенотип клеточной поверхности).
На сегодяшний день проточная цитометрия - ведущий метод в клинической иммунологии. В клинической гематологии он может быть использован для решения следующих задач:
· иммунофенотипирования лимфоцитов, включая определение количества CD4+, CD8+ клеток и даже ТН1 и ТН2 (по продукции специфических цитокинов);
· анализа процессов клеточной активации и пролиферации клеток иммунной системы;
· оценки внутриклеточной продукции цитокинов различными клеточными популяциями ;
· иммунофенотипирования острых лейкозов и лимфом;
· анализа клеточного цикла с определением распределения клеточной популяции по фазам цикла (ДНК-цитометрия);
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.