В 1928 г. О. Дильс и К. Альдер (Нобелевская премия 1950 г.) открыли реакцию своего имени или «реакцию диенового синтеза».
В реакции Дильса-Альдера взаимодействие сопряженного диена с диенофилом (соединением с активированной кратной связью) приводит к образованию шестичленного циклического алкена (аддукта).
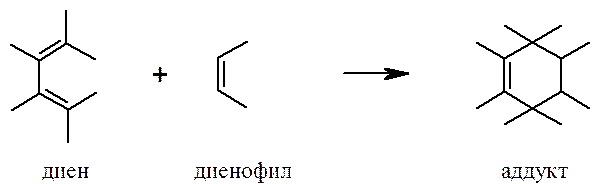
Диены и диенофилы, не имеющие заместителей, вступают в реакцию с большим трудом. Бутадиен-1,3 реагирует с этиленом с низким выходом только при температуре более 200оС и давлении около 400 атм. В случаях, когда диен несет электронодонорные, а диенофил – электроноакцепторные заместители, реакция обычно протекает при комнатной температуре или незначительном нагревании с количественным выходом.
Эта реакция очень важна для препаративной органической химии, поскольку позволяет в одну стадию из простых исходных веществ получить сложные циклические соединения.
Реакция Дильса-Альдера классифицируют как [4+2]-циклоприсоединение. Это один из вариантов так называемых перициклических реакций, составляющих самостоятельный раздел органической химии.
В течение долгого времени реакцию Дильса-Альдера относили к так называемым «реакциям без механизма», поскольку никаких промежуточных продуктов в этом превращении не удавалось и до настоящего времени не удалось зафиксировать.
Несмотря на то, что, как видно из схемы, реакция представляет собой сложный процесс, в котором суммарно происходит разрыв трех p-связей и образование двух s- и одной p-связи, процесс является одностадийным, проходящим через единственное переходное состояние.
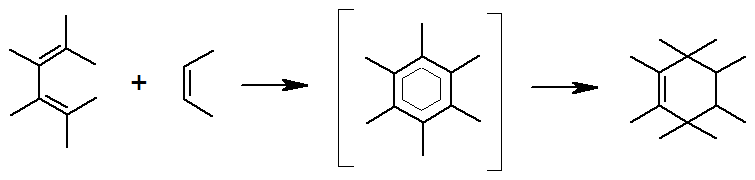
В циклическом переходном состоянии происходит согласованный процесс перераспределения электронной плотности. Атомы С-1 и С-4 диена, а также углероды кратной связи диенофила изменяют тригональную гибридизацию на тетраэдрическую, с образованием двух s-связей. Второй и третий атомы диена сохраняют начальную гибридизацию с образованием двойной связи. Так как s-связи энергетически выгоднее, чем p-связи, реакция протекает с выделением тепла.
Поскольку в сопряженных диенах связь С2-С3 имеет частично двоесвязанный характер благодаря сопряжению p-электронов, свободное вращение относительно этой связи затруднено. Сопряженные диены могут существовать в двух устойчивых s-цис- и s-транс-конформациях (s – от ангийского single).
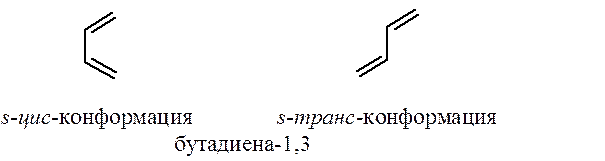
Согласованный процесс перераспределения электронной плотности в реакции Дильса-Альдера осуществляется только в том случае, если диен находится в s-цис-конформации.
В реакцию наряду с производными бутадиена-1,3 могут вступать циклические, гетероциклические диены, а также гетеродиены. Некоторые возможные структуры приведены ниже:
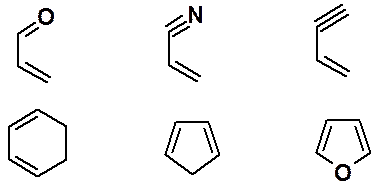
В качестве диенофилов наиболее часто используют малеиновый ангидрид, тетрацианэтилен, акриловую кислоту и ее производные – нитрил и эфиры.
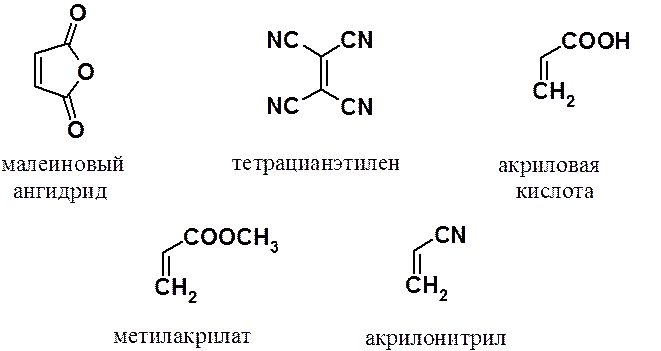
Кроме олефинов, в реакции Дильса-Альдера могут быть использованы алкины и соединения, имеющие двойную связь углерод-гетероатом. Например, следующие группировки:
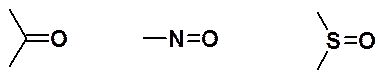
Как и этиленовые углеводороды, сопряженные диены способны вступать в реакцию полимеризации с образованием ВМС. В зависимости от механизма полимеризации процесс может протекать как 1,2- или 1,4-присоединение мономерных фрагментов. В случае радикального механизма образуется полимер с беспорядочным расположением 1,2- и 1,4-фрагментов.
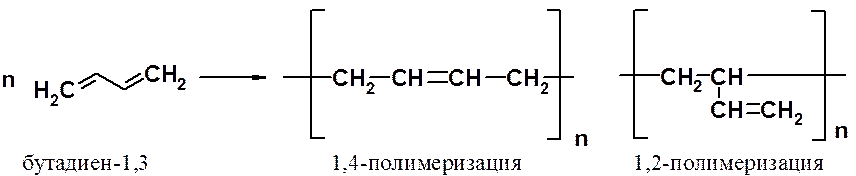 Сопряженные диены играют очень важную
роль при получении высокомолекулярных соединений, поскольку из
2-метилбутадиеновых (изопреновых) звеньев построены молекулы натурального
каучука.
Сопряженные диены играют очень важную
роль при получении высокомолекулярных соединений, поскольку из
2-метилбутадиеновых (изопреновых) звеньев построены молекулы натурального
каучука.
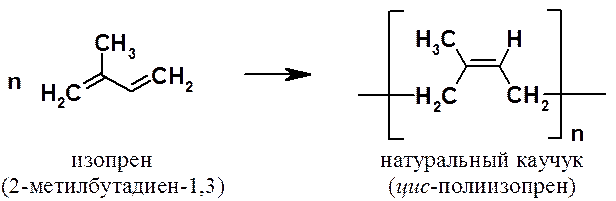
В первой трети ХХ века в СССР, США и Германии велись интенсивные исследования по получению синтетического каучука.
В 1930 г. в СССР впервые в мировой практике был осуществлен синтез полибутадиенового каучука по методу С.В. Лебедева. В 1932 г. в США был получен неопрен (хлоропреновый каучук).
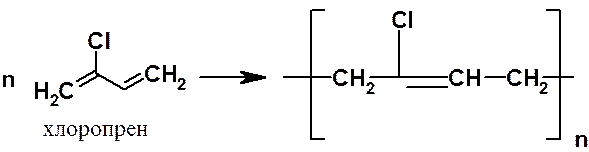
Улучшение свойств полибутадиенов достигали с помощью сополимеризации. Так, сополимер, состоящий из одной части стирола (С6Н5СН=СН2) и трех частей бутадиена – бутадиенстирольный каучук, – широко применяли во время второй мировой войны для замены недоступного натурального каучука.
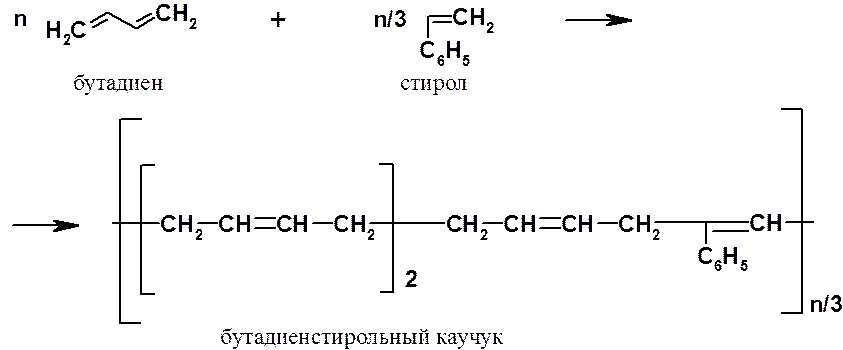
Из сополимеров бутадиена следует отметить еще бутадиеннитрильный каучук, который проявляет высокую стойкость к воздействию углеводородов (бензина, керосина, смазочных масел и т.п.).
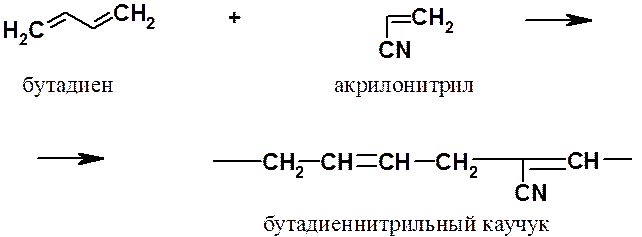
До середины ХХ века получаемый в промышленности полимеризацией по радикальному механизму полиизопрен (синтетический каучук) по своим физико-химическим свойствам заметно уступал натуральному каучуку. Это объясняется тем, что при радикальной полимеризации не удается осуществлять стереохимический контроль реакции. Радикальная полимеризация изопрена приводит к атактическому полимеру с хаотичным расположением фрагментов 1,2- и 1,4-полимеризации, тогда как натуральный каучук – продукт исключительно 1,4-полимеризации с цис-расположением фрагментов относительно двойных связей.
В 1953 г. К. Циглер и Дж. Натта (Нобелевская премия 1963 г.) предложили использовать для проведения стереорегулярной полимеризации катализатор, состоящий из триэтилалюминия, хлорида титана и мелкораздробленного металлического лития. Реакция заключается во внедрении молекул мономера в связь между металлом катализатора и растущей полимерной цепью. В качестве примера ниже приведена полимеризация полиэтилена при помощи катализатора Циглера-Натта.
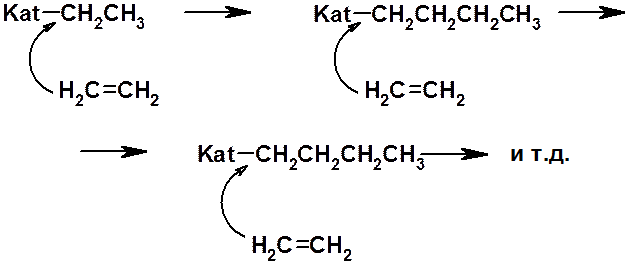
Использование катализаторов Циглера-Натта позволило провести стереоселективную полимеризацию изопрена, получив цис-полиизопрен практически не отличимый от натурального каучука.
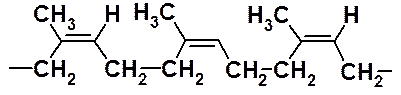
· Алициклические соединения. Классификация, номенклатура, изомерия.
· Циклоалканы. Методы получения: из дигалогеналканов внутримолекулярной реакцией Вюрца, декарбоксилированием солей двухосновных карбоновых кислот, из малонового эфира и дигалогеналканов, реакцией диенового синтеза, гидрированием ароматических соединений.
· Химические свойства. Взаимодействие с галогенами, галогеноводородами, каталитическое гидрирование. Зависимость между реакционной способностью циклоалканов и размерами цикла. Стереохимические причины специфических свойств циклопропана. Конформации четырех-, пяти- и шестичленных циклоалканов. Конформационные переходы и их энергетические характеристики.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.