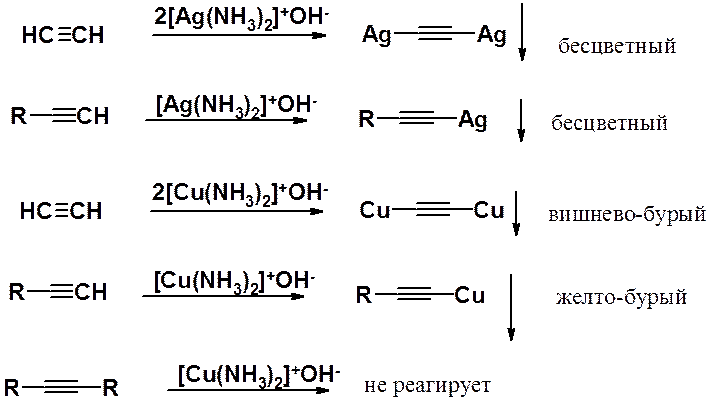
В ацетиленидах тяжелых металлов связь металл-углерод намного менее полярна, чем в производных щелочных металлов. Эти соединения в водных растворах выпадают в осадок. Образование осадка ацетиденида серебра или меди часто используют как качественную реакцию на концевую тройную связь. Если тройная связь находится в глубине цепи, образования ацетиленида (выпадение осадка) не происходит. При работе с ацетиленидами тяжелых металлов следует соблюдать особые меры предосторожности, поскольку эти вещества взрывоопасны.
Реакция с карбонильными соединениями. Ацетилен, как и алкины с концевой тройной связью, в присутствии щелочей реагируют с карбонильными соединениями (альдегидами и кетонами) с образованием ацетиленовых спиртов. Взаимодействие ацетилена с ацетоном (реакция Фаворского):
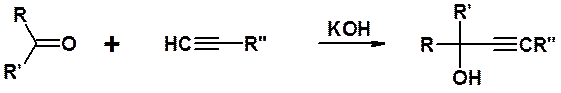
· Химические свойства алкинов. Каталитическое гидрирование (полное и частичное). Реакции электрофильного присоединения: взаимодействие с галогенами, галогеноводородами. Реакции нуклеофильного присоединения: взаимодействие со спиртами, карбоновыми кислотами, циановодородом, восстановление натрием в аммиаке, реакции с аминами и амидами. Гидратация алкинов (реакция Кучерова) и понятие о кето-енольной таутомерии. Окисление. Полимеризация алкинов.
· Особенности тройной углерод-углеродной связи в сравнении с двойной.
Химические свойства алкинов определяются наличием в молекуле тройной углерод- углеродной связи. Наиболее характерны для алкинов, как и для алкенов, реакции присоединения, которые проходят ступенчато.
Гидрирование
Гидрирование алкинов на гетерогенном катализаторе (см. раздел «Алкены») происходит аналогично реакции алкенов и приводит всегда к насыщенным производным, т.е. тройная связь восстанавливается до одинарной.
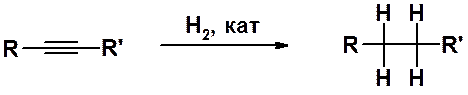
Присоединение двух молекул водорода происходит последовательно, однако промежуточно образующийся алкен невозможно выделить в условиях реакции, т.к. его гидрирование происходит быстрее, чем гидрирование исходного алкина.
Получение алкенов гидрированим ацетиленовых углеводородов может быть проведено при восстановлении алкинов натрием в жидком аммиаке или водородом над катализатором Линдлара (специальным образом приготовленный палладиевый катализатор).
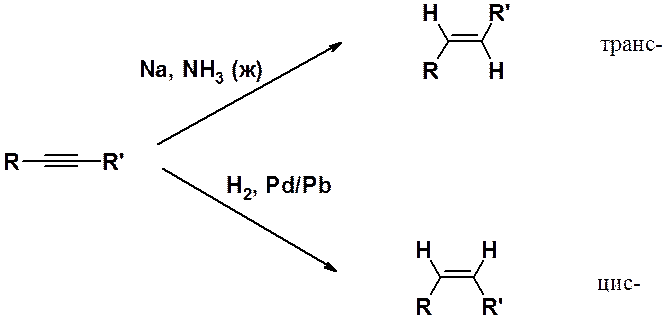
Парциальное гидрирование протекает стереоспецифично. Гидрирование в жидком аммиаке всегда приводит к транс-, а на катализаторе Линдлара – к цис-производным.
Реакции электрофильного присоединения. Тройная углерод-углеродная связь состоит из одной s- и двух p-связей. p-Электронная плотность в пространстве между двумя sp-гибридизованными атомами углерода выше, чем в алкенах. Учитывая известные свойства алкенов (см. выше), может быть сделано предположение, что алкины в реакциях электрофильного присоединения будут более реакционоспособны, чем алкены. Однако экспериментальные данные показывают, что в большинстве случаев тройная связь менее активна в реакциях электрофильного присоединения, чем двойная. Этот факт может быть объяснен следующим образом:
1) p-электроны тройной связи в значительно большей степени, чем в алкенах, втянуты в пространство между ядрами углерода и прочнее удерживаются ими. Электрофилу сложнее атаковать p-электроны алкина, чем алкена;
2) взаимодействие алкина с электрофилом приводит к образованию не алкильного, а винильного карбокатиона. Положительный заряд последнего сосредоточен на sp2-гибридизованном атоме углерода. Электроотрицательность sp2-углерода выше, чем у sp3, что дестабилизирует промежуточно образующийся карбокатион, затрудняя реакцию.
Присоединение галогенов. Хлор и бром последовательно, в две стадии, присоединяются к тройной связи с образованием сначала дигалогеноалкена, а затем тетрагалогеноалкана. Тщательный подбор условий позволяет либо остановить реакцию на стадии непредельного дигалогенопроизводного (эквимолярное соотношение реагентов и низкая температура), либо получать тетрагалогеноалканы (избыток галогена и повышенная температура).
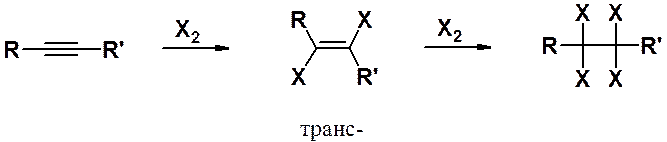
Первая стадия присоединения протекает преимущественно как анти-присоединение, приводя к транс-алкенам. Реакция с бромом может быть использована как качественная реакция на тройную связь, поскольку в ходе присоединения происходит обесцвечивание бромной воды.
Присоединение галогеноводородов. Присоединение галогеноводородов к алкинам протекает в две стадии. На первой присоединение к тройной связи идет значительно медленнее, чем аналогичное присоединение галогенов. Причины такого поведения алкинов были объяснены ранее. Реакции значительно ускоряются при использовании в качестве катализатора солей двухвалентной ртути или одновалентной меди.
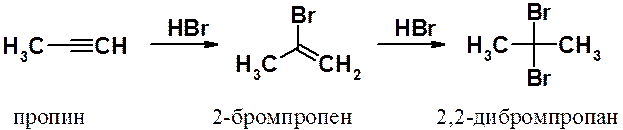
Обе реакции, как и в ряду алкенов, протекают через наиболее устойчивый промежуточный карбокатион. Поэтому в результате образуются гем-дигалогенопроизводные алканов.
Гидратация алкинов (реакция М.Г. Кучерова, 1881 г.). Присоединение воды к ацетиленам разительно отличается от аналогичной реакции в этиленовом ряду. Взаимодействие протекает только в водном растворе кислоты в присутствии солей двухвалентной ртути и приводит к образованию карбонильного соединения, а не соответствующего спирта. Так, гидратация ацетилена приводит к ацетальдегиду.
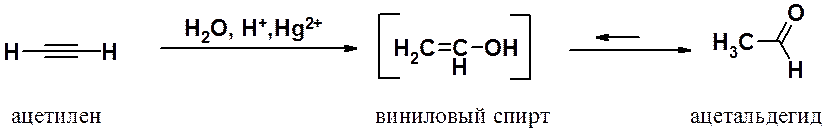
Механизм реакции Кучерова:
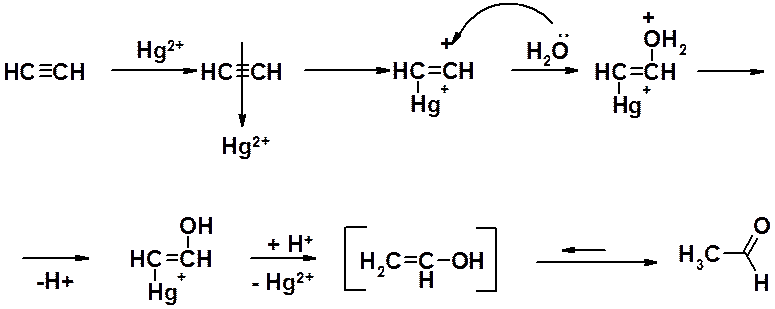
1) Ион двухвалентной ртути взаимодействует с тройной связью, оттягивает к себе часть p-электронов, уменьшая электронную плотность в пространстве между sp-гибридизованными атомами углерода и создавая возможность атаки тройной связи нуклеофильным реагентом – водой.
2) Вода атакует позитивированную ртутью тройную связь, образуя связь С-О за счет одной из своих свободных пар электронов, с образование оксониевого катиона.
3) Протон отщепляется от катионного центра и происходит превращение ртутного производного в непредельный спирт.
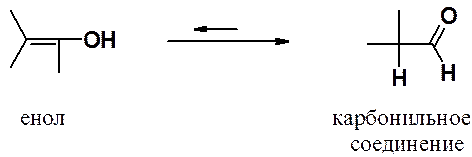
4) Таутомерное превращение непредельного (винилового) спирта в карбонильное соединение.
Промежуточно образующиеся в ходе гидратации алкинов виниловые спирты имеют общее название – енолы (ен- указывает на наличие двойной связи, ол- - на гидроксильную группу спирта).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.