По химическим свойствам бифенил – типичное ароматическое соединение. Для него характерны реакции SEAr. Проще всего рассматривать дифенил как бензол, несущий фенильный заместитель. Последний проявляет слабые активирующие свойства. Все типичные для бензола реакции идут и в бифениле.
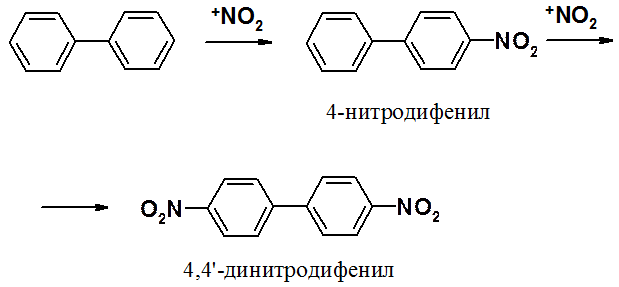
Поскольку арильная группа является орто- и пара-ориентантом, реакции SEAr идут преимущественно в пара-положение. Орто-изомер является побочным продуктом вследствие стерических препятствий.
Ди- и трифенилметаны – гомологи бензола, в которых соответствующее число атомов водорода замещено на фенильные остатки. Бензольные циклы разделены sp3-гибридизованным углеродным атомом, что препятствует сопряжению. Кольца абсолютно изолированы.

Методы получения дифенилметана:
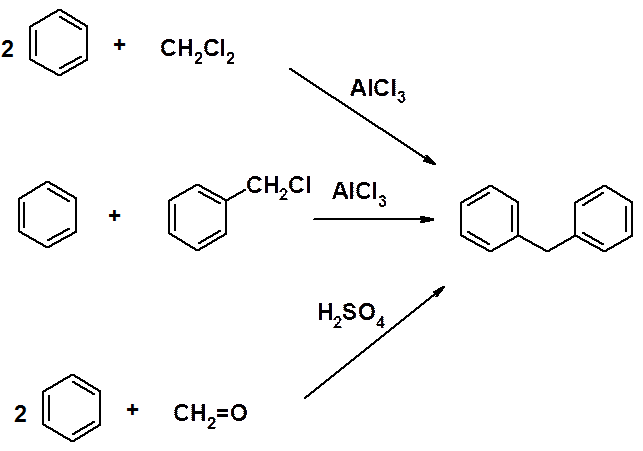
Реакции SEAr протекают в орто- и пара-положения бензольных колец дифенилметана.
Получение трифенилметана и его производных:
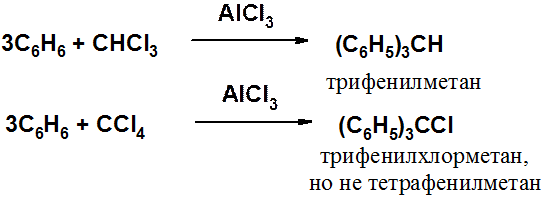
Отличительная особенность производных трифенилметана – высокая подвижность атома водорода, связанного с тетраэдрическим углеродом.
Трифенилметан проявляет заметную кислотность, вступая в реакцию с металлическим натрием с образованием очень устойчивого трифенилметильного аниона.
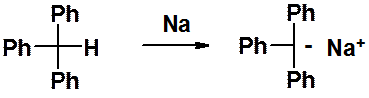
Трифенилхлорметан в водном растворе диссоциирует с образованием устойчивого карбокатиона.
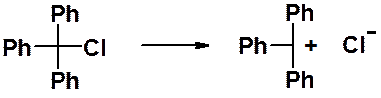
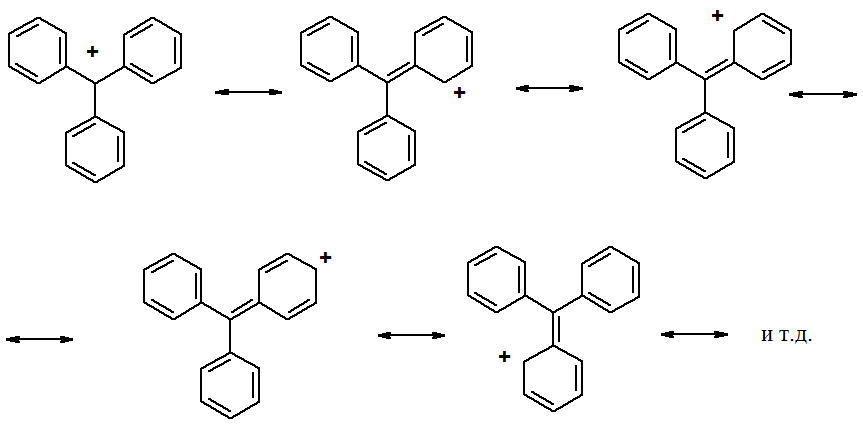
В некоторых производных трифенилметана разрыв С-Н связи может протекать гомолитически с образованием трифенилметильного радикала – хронологически первого из открытых стабильных свободных радикалов.
Причины высокой стабильности трифенилметильного катиона, аниона и радикала можно понять, рассмотрев строение катиона. Если изобразить трифенилметильный катион с помощью граничных структур, становится понятно, что свободная орбиталь центрального углеродного атома находится в сопряжении с p-электронами бензольных колец.
· Многоядерные ароматические углеводороды с конденсированными ядрами. Линеарные и ангулярные полициклические углеводороды. Выделение их из каменноугольной смолы. Канцерогенные свойства полициклических углеводородов.Техника безопасности при работе с ароматическими углеводородами.
· Нафталин. Изомерия и номенклатура производных. Строение, ароматичность. Химические свойства нафталина и его производных: окисление, каталитическое гидрирование и восстановление натрием в жидком аммиаке, реакции ароматического электрофильного замещения. (влияние заместителей на ориентацию, активность a-положения).
· Антрацен. Номенклатура, строение, ароматичность (в сравнении с бензолом и нафталином), изомерия производных. Реакции окисления и восстановления, электрофильного присоединения и замещения. Активность мезо-положения.
· Фенантрен. Номенклатура, строение, ароматичность (в сравнении с бензолом и нафталином). Реакции окисления, восстановления, электрофильного замещения и присоединения.
Полициклические ароматические соединения могут быть линеарными, ангулярными или перициклическими.

Полициклические соединения выделяют из каменноугольной смолы. Очень многие среди них обладают выраженным канцерогенным действием. Чем больше циклов, тем вероятнее канцерогенность.
Простейшее бициклическое ароматическое соединение.
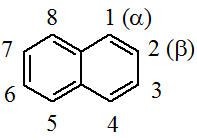
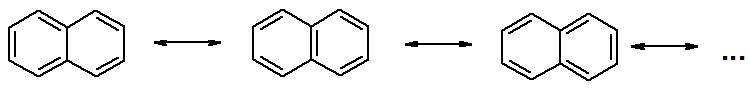
Хотя молекулярная формула указывает на ненасышенный характер нафталина, его свойства типичные для ароматических соединений. Нафталин удовлетворяет структурным критериям ароматичности. Циклическая плоская система, имеющая непрерывную цепь сопряжения, в котором участвую 10 p-электронов. Следует помнить, что Хюккель формулировал свое правило (4n + 2) для моноциклических систем. В случае нафталина считают, что в каждом цикле находится по 6 делокализованных электронов, а одна из пар является общей для обоих колец. Сопряжение показывают с помощью канонических структур:
В результате: выше и ниже плоскости циклов находятся p-электронные облака, имеющие форму «восьмерки» Рис. 20.1.
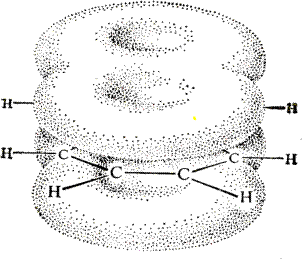
Рис. 20.1. Форма p-электронных облаков молекулы нафталина
В нафталине не все С-С связи одинаковы. Так, длина С1-С2 равна 1,365 Å, а С2-С3 – 1,404 Å. Энергия сопряжения нафталина 61 ккал/моль, что меньше удвоенной энергии делокализации бензола (2х36 ккал/моль). Второй цикл вносит в сопряжение меньше, чем первый. Нафталин менее ароматичен, чем бензол. Нарушение ароматичности одного из его циклов требует всего 25 ккал/моль, что и проявляется в его реакциях.
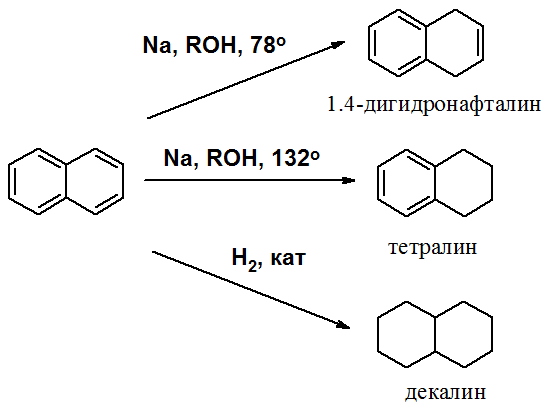
Окисление нафталина протекает аналогично окислению бензола.

Образующаяся фталевая кислота в условиях реакции превращается во фталевый ангидрид, который и выделяют в результате реакции.
Реакции восстановления также иллюстрируют меньшую ароматичность нафталина в сравнении с бензолом. Нафталин можно гидрировать химическими восстановителями в мягких условиях.
В целом реакции SEAr в нафталине протекают по общему механизму, рассмотренному ранее. Особенность реакций в нафталиновом ряду заключается в том, что монозамещенные нафталины существуют в виде двух изомеров (1- и 2-производные). Особенности реакций SEAr рассмотрены на примере реакции нитрования, основной продукт которой 1-нитронафталин (2-изомера – следы).
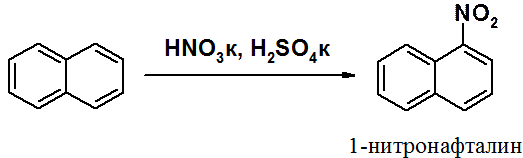
Ключевая стадия реакции - образование s-комплекса, которых может быть два. Надо определить структурные факторы, которые стабилизируют или дестабилизируют интермедиат. На этой основе можно предсказать и объяснить протекание замещения. Рассмотрим строение возможных промежуточных продуктов.
При атаке электрофила по положению 1 нафталина образуется s-комплекс, строение которого может быть описано двумя граничными структурами, в которых сохраняется бензольный цикл. Такие структуры более стабильны за счет бензольного сопряжения. При атаке электрофила в положение 2 можно нарисовать только одну энергетически выгодную структуру.

Можно сделать вывод, что электрофильная атака в положение 1 нафталина приводит к более устойчивому s-комплексу, чем реакция в положение 2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.