Экспериментальные факты могут быть объяснены только особенностями строения бутадиена (да и вообще сопряженных диенов).
Алканы, алкены и алкины построены за счет локализованных связей. Такая связь образуется при перекрывании двух атомных орбиталей (АО), а образующаяся связывающая молекулярная орбиталь (МО) является двухцентровой и охватывает два ядра.
В некоторых веществах перекрывание р-орбиталей нескольких атомов образует несколько МО, охватывающих более двух атомов. В этом случае говорят о делокализованных связях, которые характерны как раз для сопряженных систем.
Для объяснения повышенной стабильности и нестандартных длин связей в молекуле бутадиена-1,3 следует подробно рассмотреть четыре sp2-гибридизованных атома углерода, имеющихся в любом сопряженном диене.
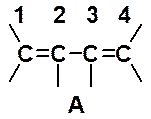
В классических химических формулах каждая черточка означает локализованную химическую связь, т.е. пару электронов. Связи между первым и вторым, а также третьим и четвертым углеродными атомами обозначают как двойную, а между вторым и третьим углеродами - как одинарную (структура А). Перекрывание р-орбиталей, приводящее к образованию двух p-связей, показано на рис. 14.1.а.
Такое рассмотрение абсолютно не учитывает тот факт, что р-электроны атомов С-2 и С-3 также могут перекрываться. Такое взаимодействие показано с помощью следующей формулы Б:
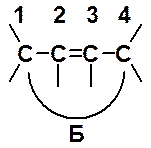
Дуга указывает на формальную связь между первым и четвертым углеродами диенового фрагмента. Использование для описания строения молекулы бутадиена формулы Б позволяет объяснить уменьшенную длину связи С-2 – С-3. Однако простейшие геометрические расчеты показывают, что расстояние между первым и четвертым углеродными атомами 0,4 нм, что значительно превышает длину простой связи.
Поскольку описание структурных формул на бумаге очень ограничено – валентные черточки показывают лишь локализованные связи, – Л. Полинг предложил использовать для сохранения концепции ковалентных связей и привычного изображения молекул так называемую теорию резонанса (метод валентных схем).
Основные принципы этой концепции:
· Если молекула не может быть правильно отображена одной структурной формулой, то для ее описания используется набор граничных (канонических, резонансных) структур.
· Реальная молекула не может быть удовлетворительно представлена ни одной из граничных структур, а представляет собой их суперпозицию (резонансный гибрид).
· Реальная молекула (резонансный гибрид) стабильнее, чем любая из резонансных структур. Увеличение стабильности реальной молекулы называют энергией сопряжения (делокализации, резонанса).
При написании граничных структур следует выполнять следующие требования:
· Геометрия ядерных конфигураций граничных структур должна быть одинаковой. Это означает, что при написании канонических структур может изменять только расположение электронов p-, но не s- связей.
· Все канонические структуры должны быть «структурами Льюиса», т.е., например, углерод не может быть пятиковалентным.
· Все атомы, участвующие в сопряжении, должны лежать в одной плоскости или близко к одной плоскости. Условие копланарности вызвано необходимостью максимального перекрывания p-орбиталей.
· Все граничные структуры должны иметь одинаковое количество неспаренных электронов. Поэтому бирадикальная формула Г бутадиена не является канонической.
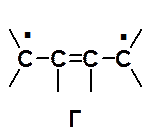
Ниже представлены граничные структуры бутадиена (А и Б) и их суперпозиция. Пунктирная линия показывает делокализацию p-электронов, т.е. что в реальной молекуле p-электронная плотность находится не только между 1 и 2, 3 и 4 атомами углерода, но и между 2 и 3 атомами.
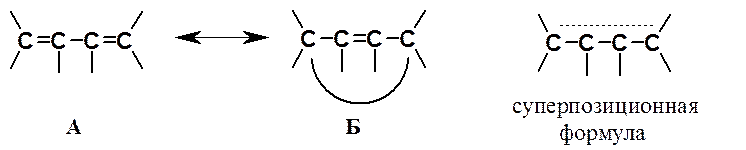
Чем стабильнее каноническая структура, тем больше ее вклад в реальную молекулу. Граничные структуры – фикция, отражающая возможное, но не реальное расположение p-электронов. Следовательно, «стабильность граничной структуры» - стабильность фикции, а не молекулы, существующей в реальности.
Несмотря на то, что граничные структуры не являются отражением объективной реальности, этот подход оказывается весьма полезным для понимания строения и свойств. “Вклад” граничных структур в реальное сопряжение p-электронов пропорционален их стабильности. Такая оценка облегчается при использовании следующих правил:
1) чем в большей степени разделены заряды, тем меньше устойчивость структуры;
2) структуры, несущие разделенные заряды, менее устойчивы, чем нейтральные;
3) структуры, имеющие более 2 зарядов, обычно не вносят никакого вклада в сопряжение;
4) самые неэффективные структуры те, которые несут одинаковые заряды на соседних атомах;
5) чем выше электроотрицательность атома, несущего отрицательный заряд, тем более устойчива структура;
6) нарушение длин связей и валентных углов приводит к снижению стабильности структуры (см. структуру Б, указанную выше);
7) большей устойчивостью обладает граничная структура, имеющая больше связей.
Использование этих правил позволяет утверждать, что хотя формально молекула этилена может быть описана двумя граничными структурами М и Н (см. ниже), вклад структуры Н с разделенными зарядами столь ничтожен, что ее можно исключить из рассмотрения.
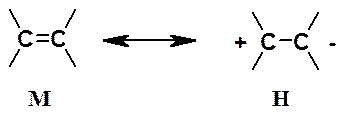
Следует особо обратить внимание на использованную для перехода между граничными структурами обоюдоострую, т.н. «резонансную» стрелку. Такой знак указывает на фиктивность изображенных структур.

Грубейшей ошибкой является использование при описании граничных структур двух однонаправленных в разные стороны стрелок, указывающих на протекание обратимой реакции. Столь же грубой ошибкой является и использование при описании равновесного процесса, т.е. реально существующих молекул, «резонансной» стрелки.
Таким образом, в молекуле бутадиена за счет сопряжения р-орбиталей четырех атомов углерода наблюдается повышение p-электронной плотности между вторым и третьим атомами углерода. Это приводит к некоторой двоесвязанности С-2 и С-3, что выражается в уменьшении длины связи до 0,147 нм, по сравнению с длиной простой связи в 0,154 нм.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.