Для бензола характерны реакции замещения. Поскольку над и под плоскостью бензольного цикла есть две тороидальные области повышенной электронной плосности, бензольное кольцо может быть атаковано частицей, имеющей недостаток электронов - электрофилом. Это реакции SEAr – ароматического электрофильного замещения (сокращение читается справа налево).
Реакция SEAr состоит из следующих стадий:
· образование p-комплекса - диполь-дипольное взаимодействие электрофила с ароматической системой;
· образование s-комплекса - электрофил вытягивает из ароматической системы пару электронов, образуя сигма-связь с атомом углерода;
· реароматизация – отщепление протона с образованием замещенной ароматической молекулы.

Строение s-комплекса может быть показано тремя граничными структурами с различным расположением p-электронов и карбокатионного центра. Реальный s-комплекс – суперпозиция граничных структур, в котором атом углерода, участвующий в реакции, находится в sp3-гибридизованном состоянии, а остальные - в sp2. Положительный заряд делокализован (распределен) по пяти sp2-углеродным атомам. Положительный заряд – недостаток электронов, а не наличие частицы с плюсом. Следовательно, делокализованный положительный заряд – делокализация четырех электронов по пяти углеродным атомам. Формально можно рассчитать так: 5 (углеродов) минус 4 (электрона) = +1 (заряд s-комплекса). В показанных выше граничных структурах на трех углеродных атомах есть плюс. Это означает, что в s-комплексе нет идеальной выровненности p-электронной плотности, как в молекуле бензола. На тех атомах, у которых в граничных структурах положительный заряд, электронная плотность ниже, чем у двух других.
Последняя стадия реакции – реароматизация. Как уже отмечалось, ароматические системы характеризуются высокой устойчивостью (низким содержанием энергии), благодаря делокализации p-электронов (см. энергию сопряжения). Нарушение ароматической системы ведет к увеличению энергии, возврат к ароматическому циклу – к уменьшению. Именно поэтому происходит отщепление протона, а не присоединение к s-комплексу какой-либо нуклеофильной частицы.
Из энергетического профиля реакции SEAr (рис. 18.1) можно сделать вывод, что первая стадия реакции (образование s-комплекса) является определяющей. Её энергия активации (Еа1) значительно большее энергии активации второй стадии (Еа2).
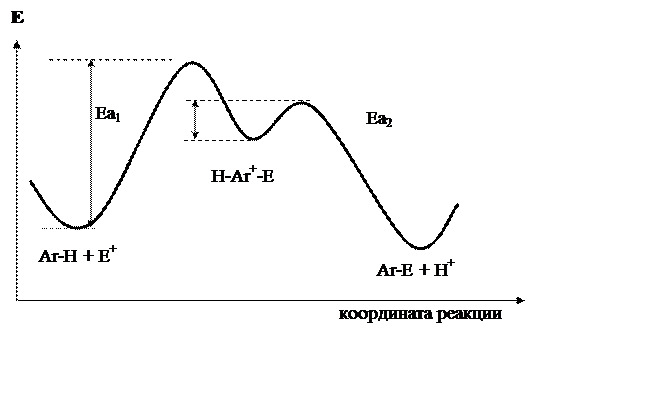 |
Рис. 18.1. Энергетическая диаграмма реакции
ароматического электрофильного замещения
Доказательством правильности изложенного механизма является отсутствие первичного кинетического изотопного эффекта в реакциях SEAr дейтерированного бензола.
Рассмотрение рис. 18.1 позволяет сделать важный вывод. Высшая точка реакции – переходное состояние (не регистрируется), образующееся на первой стадии, по энергии ближе к промежуточному продукту (s-комплексу). Все факторы, стабилизирующие s-комплекс, будут стабилизировать (уменьшать энергию, облегчать реакцию) и переходное состояние. Рассмотрим конкретные реакции замещения, обращая внимание на природу атакующего агента.
Нитрование бензола проводится «нитрующей смесью» (смесь концентрированных азотной и серной кислот). В результате реакции образуется нитробензол.
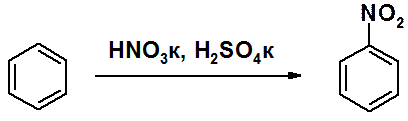
Образование электрофильной частицы происходит при взаимодействии кислот.
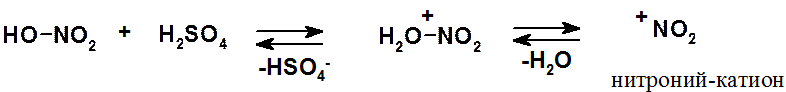
Это кислотно-основное равновесие, в котором серная кислота (более сильная) выступает в качестве кислоты (донора протона), а азотная (менее сильная) – в качестве основания (акцептора протона). Образующийся электрофильный нитроний-катион и начинает реакцию.
Непосредственно в бензольное кольцо реакцией галогенирования можно ввести только хлор и бром. Введение же фтора и йода осуществляют через соли диазония (будет рассмотрено позже).
Реакции идут только в присутствии катализаторов – кислот Льюиса. При хлорировании обычно используют безводный AlCl3, при бромировании – FeBr3. Взаимодействие хлора или брома с соответствующей кислотой Льюиса генерирует в реакционной смеси электрофил:
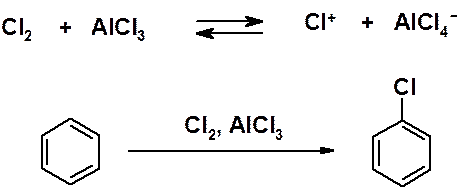
Гомологи бензола могут быть получены введением в бензольное кольцо алкильной группы по реакции Фриделя-Крафтса. Электрофил генерируется при взаимодействии кислоты Льюиса с моногалогенопроизводным.
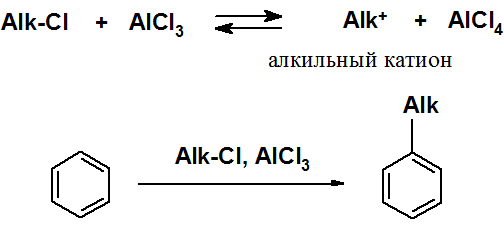
Известна модификация реакции Фриделя-Крафтса, в которой электрофил генерируется при взаимодействии алкена и минеральной кислоты.
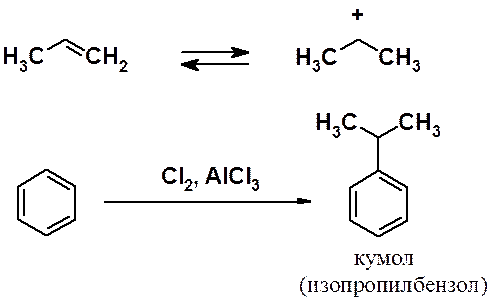
Отличие от предыдущей реакции в том, что в кольцо вводят не остаток алкана, а остаток карбоновой кислоты – ацил. В результате реакции образуются кетоны.

Сульфирование проводят либо олеумом, либо концентрированной серной кислотой. В любом случае в качестве электрофила выступает оксид серы (VI), в котором атом серы имеет недостаток электронной плотности. Сульфирование отличается от остальных реакций SEAr тем, что она обратима. Варьируя условия можно выполнить как сульфирование, так и десульфирование.
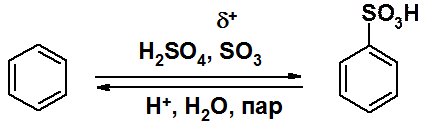
Причины особенностей реакции сульфирования понятны из рисунка 18.2. Энергии активации превращений s-аддукта в продукт реакции (Еапр) и в исходные соединения (Еаоб) очень близки.
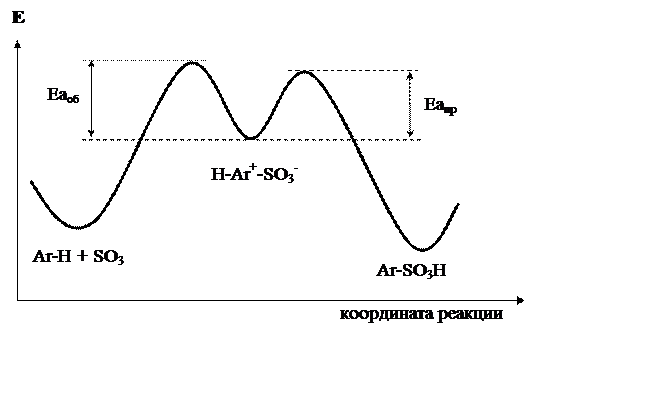 |
Рис 18.2. Энергетическая диаграмма реакции сульфирования
Высокие концентрации серной кислоты (обычно используют олеум) сдвигают реакцию в сторону сульфирования. Низкие концентрации серной кислоты (обычно в раствор сульфоновой кислоты в водной H2SO4 пропускают перегретый пар) – в сторону десульфирования.
Эта особенность реакции сульфирования часто используется в органическом синтезе. Проведя реакцию сульфирования можно заблокировать какое-то положение в бензольном кольце. Затем провести с веществом необходимые превращения. После чего удалить сульфогруппу.
· Реакции SEAr в замещенных бензолах. Факторы, влияющие на скорость реакции и соотношение образующихся изомеров. Правила ориентации. Влияние природы заместителя на устойчивость s-комплексов и направление SE реакций. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты. Согласованная и несогласованная ориентация.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.