Галогенопроизводные – органические соединения, в молекуле которых есть связь углерод – галоген (фтор, хлор, бром, йод). Их классифицируют по типу углеродного атома, с которым связан галоген:
· галогенопроизводные со связью С(sp3)-галоген – галогеноалканы;
· галогенопроизводные со связью С(sp2)-галоген, которые в свою очередь подразделяют на галогеналкены и галогеноарены.
Число и природа атомов галогена, связанных с органическим радикалом могут изменяться в широких пределах (от моно- до поли-).
Ранее рассмотрены:
· прямое галогенирование насыщенных углеводородов (смесь от моно- до пергалогеноалканов);
· присоединение галогеноводорода к p-связи (моногалогеноалканы);
· присоединение галогена к p-связи (вицинальные дигалогеноалканы);
· присоединение галогеноводорода к тройной связи (геминальные дигалогеноалканы или моногалогеноалкены);
· присоединение галогена к тройной связи (вицинальные дигалогеноалкены или тетрагалогеноалканы);
· получение аллилгалогенопроизводных;
· каталитическое галогенирование ароматических соединений.
Получение галогеноалканов может быть выполнено замещением ОН-группы в легко доступных спиртах на атом галогена. Реакция может быть проведена действием галогеноводородной кислоты на спирт.
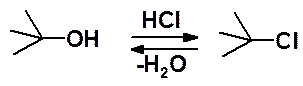
Недостатки: обратимости замещения, много побочных реакций.
Часто для замещения ОН-группы на галоген используют реакции с галогенидами форсфора. Эти синтезы необратимы и не сопровождаются побочными реакциями.
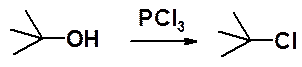
Хлорирование может быть проведено действием PCl3, POCl3 или PCl5. Бромирование - PBr3, PBr5, йодирование – PI5.
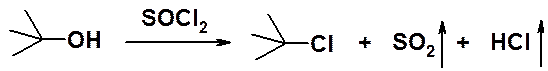
Для получения хлоропроизводных очень удобно использовать хлористый тионил (SOCl2).
Галогеноарены могут быть получены через соли диазония по следующей схеме (подробное рассмотрение будет проведено в разделе «Органические соединения азота»).
![]()
В разделе алканы уже была рассмотрена реакция галогеноалканов с металлическим натрием (реакция Вюрца), как метод получения симметричных алканов.
Восстановление алкилгалогенидов приводит к углеводородам, причем йод производные восстанавливают действием HI, а хлор- и бром- - каталитически.
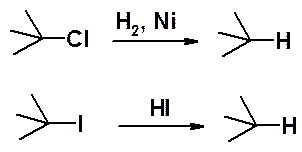
Замещение галогена на другой галоген. Это обычная равновесная реакция обмена, которую сдвигают в нужном направлении в соответствии с принципом Ле-Шателье (обычно используют крайне низкую растворимость AgCl).
![]()
Реакционная способность галогеноалканов определяется природой связи углерод-галоген. Вследствие разной электроотрицательности атомов, эта связь полярная и электронная плотность сдвинута к атому галогена. Химические свойства определяются как строением органического радикала, так и типом галогена. Свойства связи углерод-галоген следующим образом зависят от природы атома галогена.
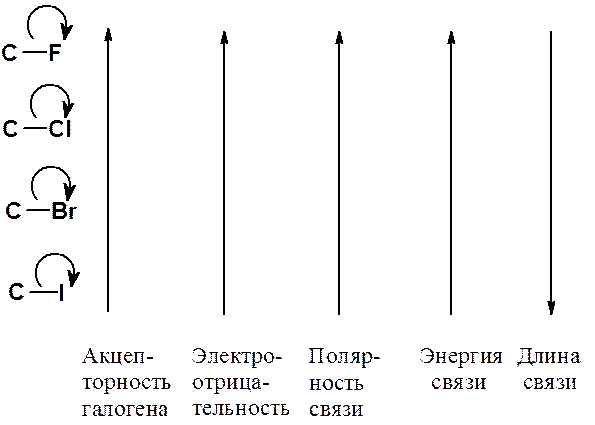
Рис. 22.1. Изменение свойств связи С-Гал в зависимости от природы галогена
Атом углерода, связанный с галогеном, позитивирован и может подвергаться атаке частицам, способными предоставить пару электронов для образования ковалентной связи – нуклеофилами. Типичные для галогеноалканов – реакции нуклеофильного замещения (SN). Рассмотрим их на примере реакции гидролиза, которая в общем виде протекает по схеме:
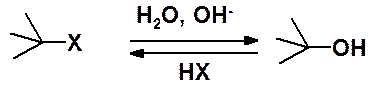
Важно: изложенные далее закономерности относятся ко всем реакциям нуклеофильного замещения в производных алканов, а не только к гидролизу галогеноалканов. Т.е. ко всем взаимодействия с нуклеофлами (например с: NH3, -NH2, Cl-, HS- и др.) и ко всем уходящим группам.
Гидролиз галогена в бромметане приводит к метанолу:
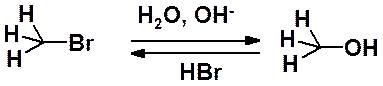
Кинетические исследования показали, что скорость этой реакции зависит от концентрации обоих реагентов:
V = k[CH3Br][OH-]
Такое взаимодействие называют реакцией второго порядка или бимолеклярной (сумма стехиометрических коэффициентов 1 + 1 = 2).
Внешне очень похож на приведенную выше реакцию гидролиз брома в трет-бутилбромиде:
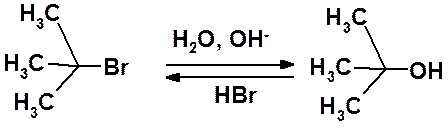
Скорость этой реакции зависит от концентрации бромопроизводного и не зависит от концентрации нуклеофила:
V = k[(CH3)3Br]
Вывод: реакции протекают по различным механизмам!
Бимолекулярное нуклеофильное замещение (SN2)
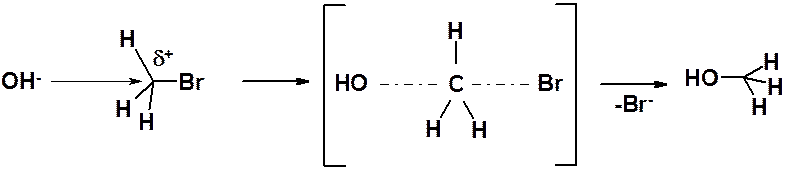
Реакция идет в одну стадию, через единственное переходное состояние (в квадратных скобках), в котором связь С-О еще полностью не образовалась, а связь С-Br еще полностью не разорвалась (показаны пунктиром). Нуклеофил всегда атакует с противоположной стороны от уходящей группы («атака с тыла»).
 |
Рис. 22.2. Энергетическая диаграмма реакции SN2
Мономолекулярное нуклеофильное замещение (SN1)
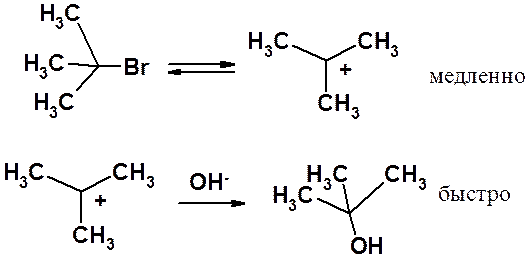
Трет-бутилбромид медленно диссоциирует на карбокатион и Br-. Образовавшийся карбокатион очень быстро (практически мгновенно) реагирует с гидроксид-анионом.
Хотя скорость реакции равна сумме скоростей первой и второй стадий, первая протекает во много раз медленнее, чем вторая, вкладом которой в суммарную скорость реакции можно пренебречь. Стадия, скорость которой определяет скорость всей реакции, называется лимитирующей. В рассмотренной реакции именно первая стадия, проходящая с поглощением энергии (см. рис. 22.3), является лимитирующей. В этой стадии принимает участие только молекула галогенопроизводного. Именно его концентрация определяет скорость всей реакции.
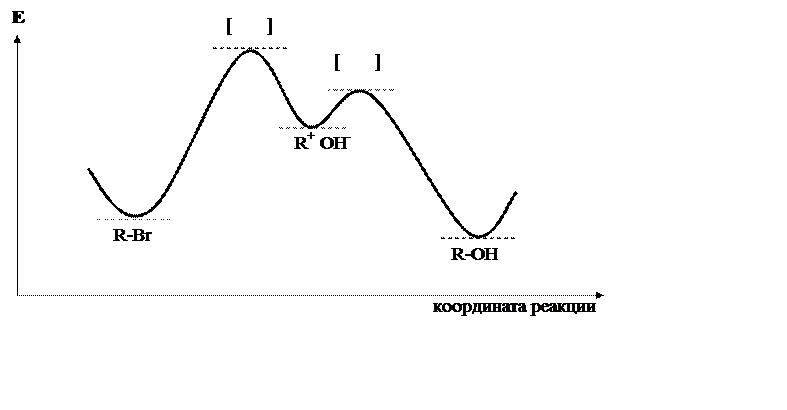 |
Рис. 22.3. Энергетическая диаграмма реакции SN1
Мономолекулярные реакции часто осложняются побочными процессами, связанными со склонностью карбокатионов к перегрппировкам.
Так, гидролиз 1-хлор-2-метилпропана в результате 1,2-гидридного сдвига приводит не к 2-метилпропанолу-1, а к трет-бутанолу.
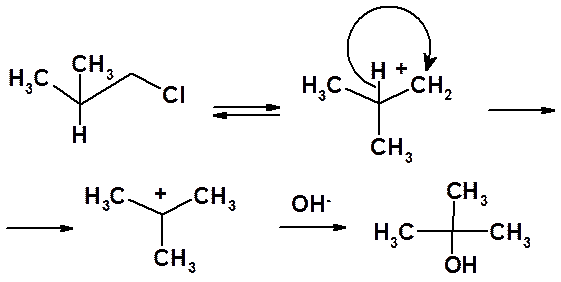
В реакции 1-бром-2,3-диметилпропана с этанолом в результате 1,2-метильного сдвига образуется не к 2,3-диметилпропанолу-1, а 2-метил-2-этоксибутан и метилбутен-2.
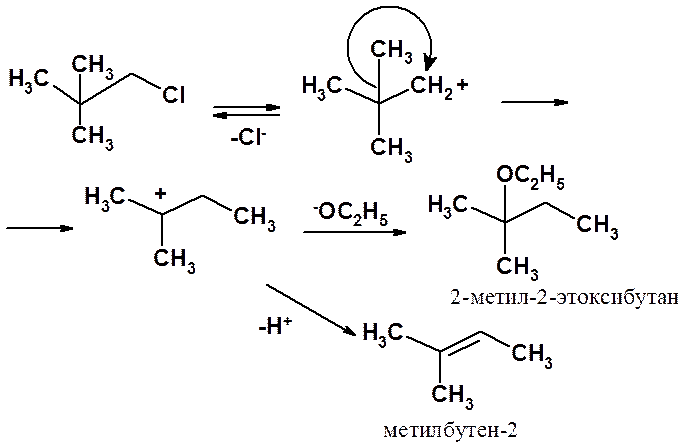
Строгое доказательство протекания реакций SN1 и SN2 по указанным выше механизмам дает совокупность данных кинетических измерений и исследования стереохимических особенностей протекания реакций.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.