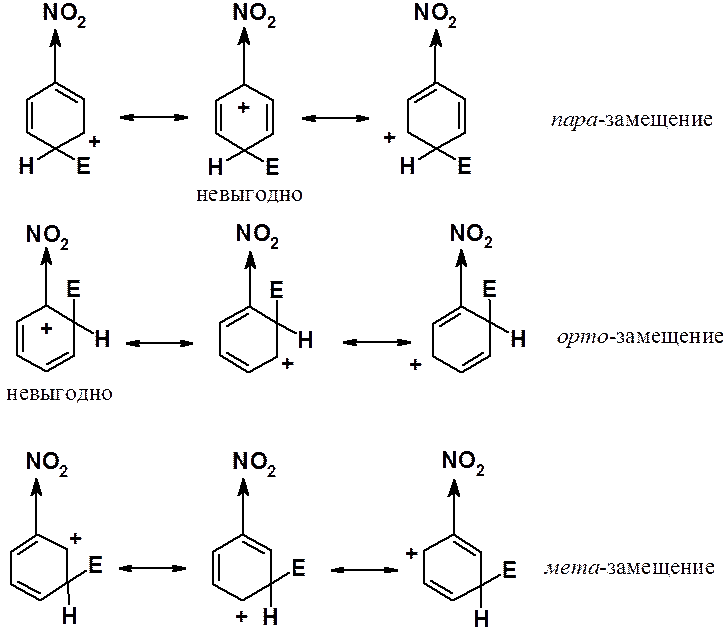
Суммируя вышеизложенное
· активирующие заместители – орто- и пара-ориентанты;
· дезактивирующие заместители – мета-ориентанты.
Все изложенное имеет одно исключение:
Галогены – дезактивирующие заместители, но орто- и пара-ориентанты.
Причина такого поведения галогенов в их двойственной природе. Они проявляют свойства индуктивных акцепторов (-I-эффект) и, одновременно, мезомерных доноров (+М-эффект).
Анализ строения s-комплексов, образующихся в ходе реакций электрофильного замещения в галогенопроизводных бензола показывает, что при реакциях в орто- и пара-положения есть по одной энергетически невыгодной граничной структуре, в которых акцепторный атом галогена связан с положительно заряженным углеродом. Кроме того, есть по одной выгодной структуре за счет сопряжения четырех p-электронов цикла с электронной парой атома галогена. При реакциях в мета-положение нет ни особо выгодных, ни особо невыгодных граничных структур. При орто- и пара-замещении интермедиаты могут быть изображены с помощью четырех граничных структур, при мета-замещении – трех. Таким образом, галогены, являясь дезактивирующими заместители, уменьшают реакционную способность всех положений (о-, м- и п-) бензольного цикла, но понижение реакционной способности в орто- и пара-положениях выражено в меньшей степени, чем в мета-.
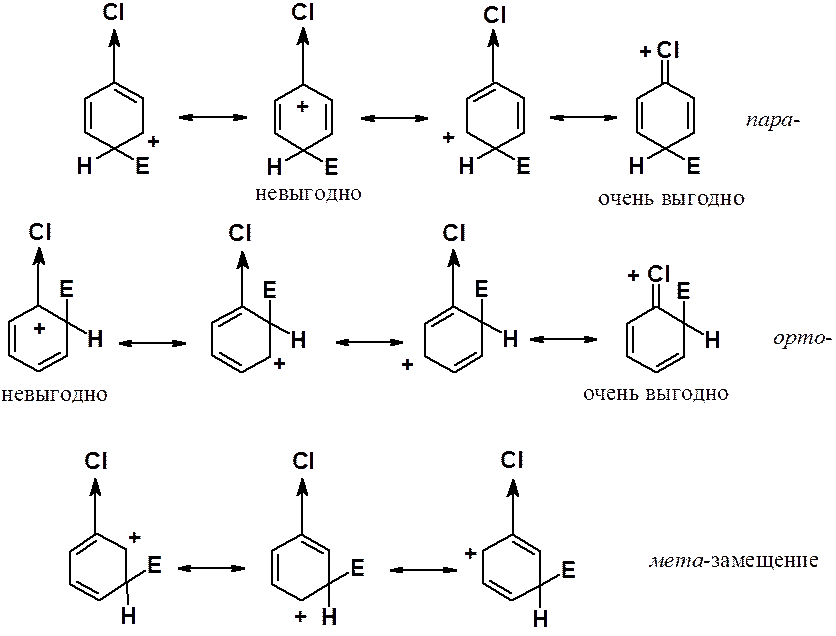
При планировании синтеза тризамещенных бензолов следует учитывать ориентирующие свойства каждого из заместителей. Возможно два варианта их совместного действия:
· согласованная ориентация;
· несогласованная ориентация.
В случае согласованной ориентации заместители направляют входящую группировку в одно и то же положение (положения) кольца. При несогласованном действии входящая группа может оказаться в самых разных положениях цикла. Планировать синтез тризамещенных бензолов надо так, чтобы образовывалось как можно меньше изомеров, т.е. в дизамещенных бензолах должна быть согласованная ориентация. Некоторые примеры согласованной и несогласованной ориентации приведены ниже.

В гомологах бензола с ароматическим циклом связаны алкильные группы, химические свойства которых аналогичных свойствам алканов. Условия реакций в ароматический цикл и боковую цепь заметно отличаются, хотя могут казаться очень похожими. Например:
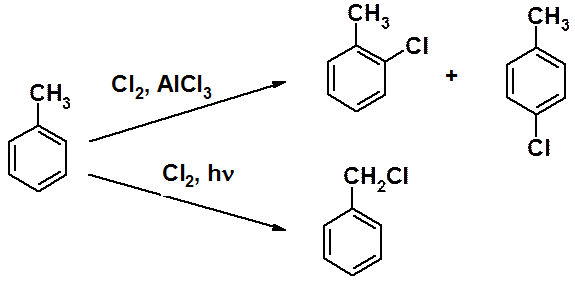
Хлорирование толуола в присутствии кислоты Льюиса проходит в кольцо как ароматическое электрофильное замещение с образованием орто- и пара-хлортолуолов. При облучении реакционной смеси ультрафиолетовым светом протекает цепная свободнорадикальная реакция замещения в боковую цепь, приводящая к бензилхлориду, а при дальнейшем хлорировании – к бензотрихлориду.
Жесткое окисление алкилбензолов приводит к бензойной кислоте или ее производным. Причем результат реакции не зависит от числа углеродов и строения алкильной группы, связанной с циклом.
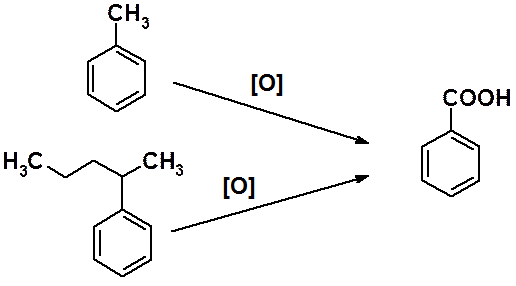
Такое окисление обычно проводят жесткими окислителями, такими как KMnO4, оксиды или соли хрома и т.п. Первоначально в этой реакции образуется альдегид, который обычно не удается выделить, поскольку он окисляется легче, чем углеводород.
Остановить окисление на стадии альдегида можно, проводя окисление оксидом хрома (VI), с последующим гидролизом диацетата в кислом водном растворе этанола.
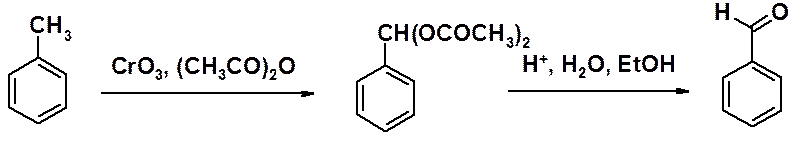
Хотя для бензола нехарактерны реакции, приводящие к потере ароматичности (см. энергию сопряжения), такие превращения известны.
В жестких условиях на оксиде ванадия бензол превращается в малеиновый ангидрид.

Гидрирование (восстановление) бензола возможно в жестких условиях в присутствии гетерогенного катализатора (Pt, Pd, Ni). В результате образуется циклогексан.

Под действием жесткого ультрафиолетового излучения бензол присоединяет три молекулы хлора, превращаясь в 1,2,3,4,5,6-гексахлорциклогексан.
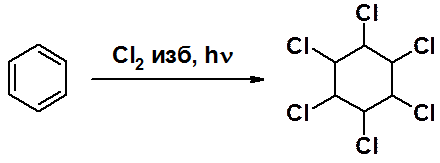
Один из девяти стереоизомеров (g-изомер) гексахлорциклогексана под названием гексахлоран широко использовался в качестве инсектицида.
Озонолиз бензола приводит к единственному альдегиду – глиоксалю.
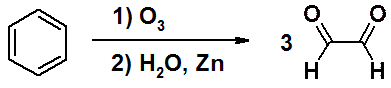
· Углеводороды группы дифенила и трифенилметана. Дифенил, строение, методы получения. Влияние заместителей на сопряжение p-электронов и копланарность циклов. Реакции SЕAr, ориентация и влияние функциональных групп в циклах. Трифенилметан, получение, свойства. Реакции, протекающие в бензольные кольца и по sp3-гибридизованному атому углерода. Анионы, катионы и стабильные свободные радикалы в ряду трифенилметана, причины их устойчивости.
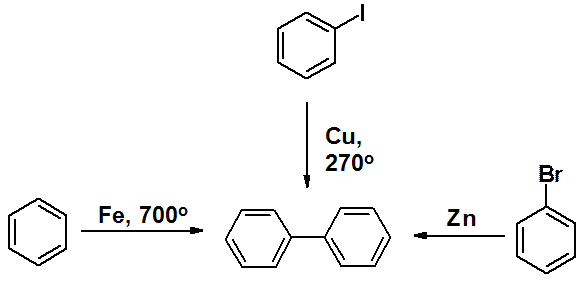
Дифенил получен Бертело в 1866 г., пропусканием бензола через раскаленную железную трубку. Кроме того, он может быть синтезирован из йодбензола в присутствии металлической меди или из бромбензола по Вюрцу-Фиттигу.
Каждое из бензольных колец имеет типичное для этой системы строение. Кроме делокализации p-электронов внутри каждого из циклов, имеется сопряжение между ними. Экзоциклическая С-С связь имеет частично двоесвязанный характер. Её длина 1,48 Å – больше двойной, но меньше простой С-С связи.
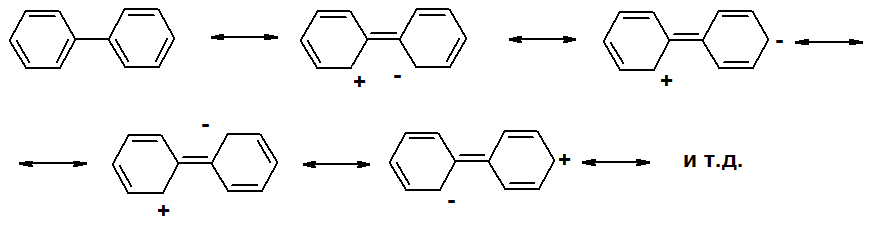
Такая делокализация еще больше увеличивает устойчивость молекулы. Сопряжение максимально, когда кольца находятся в одной плоскости. Однако этого не происходит. Двугранный угол между плоскостями бензольных колец в бифениле 19о в жидкой фазе и 42о – в газовой. Причина в стерических препятствиях – отталкивании орто-водородов.
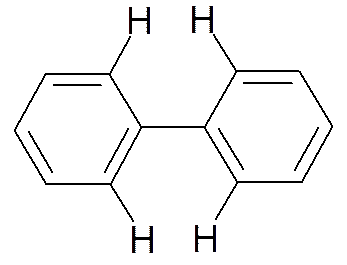
Водороды в положениях 2,6- и 2’,6’- препятствуют расположению обоих циклов в одной плоскости. Вращение вокруг экзоциклической С-С связи затруднено, но возможно. Оно становится невозможным, если сумма ковалентных радиусов заместителей в о- и о’-положениях больше 2,9 Å. Например, невозможен поворот колец относительно друг друга в о,o’-динитродифеновой кислоте.
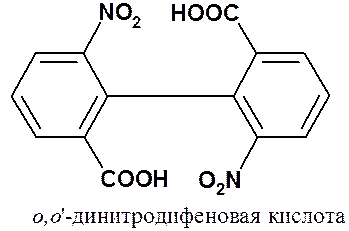
Благодаря отсутствию вращения появляется еще один вид изомерии, который будет обсуждаться позже.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.