Хлорирование и бромирование нафталина, как и нитрование, протекает в положение 1. Реакция идет настолько легко, что в отличие от бензола не требует катализатора – кислоты Льюиса.
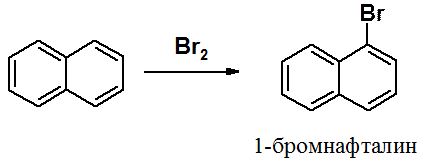
Результаты сульфирования нафталина зависят от условий проведения и связаны с обратимостью реакции.
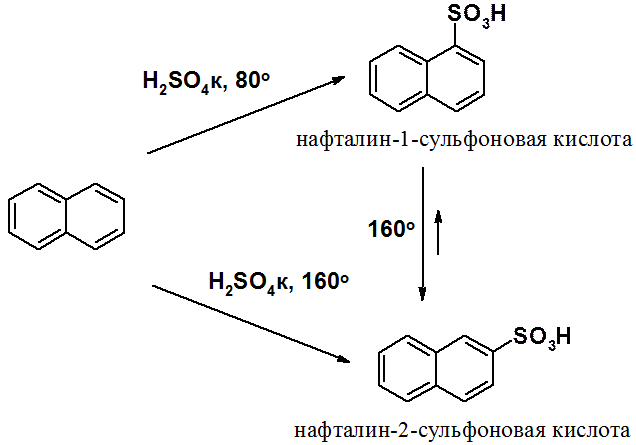
При 80о основной продукт – 1-сульфокислота, при 160о – 2-сульфокислота. Нагревание 1-изомера при 160о превращает его 2-производное. Сульфирование (по причинам, изложенным выше для реакции нитрования) легко протекает в положение 1. По тем же причинам легко протекает и реакция десульфировани. Реакция в положение 2 идет медленно, но образующийся продукт не склонен к десульфированию. При низкой температуре десульфирование проходит медленно, поэтому из реакции выделяют a-изомер. При высокой десульфирование a-производного становится заметным и из реакции выделяют более устойчивый b-изомер. Эта реакция один из классических случаев кинетического и термодинамического контроля.
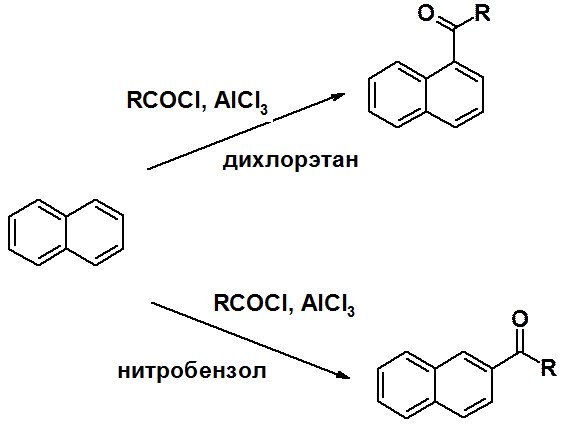
Направление ацилирования по Фриделю-Крафтсу зависит от природы растворителя, в котором проводится реакция.
Алкилирование нафталина по Фриделю-Крафтсу не имеет практического значения, т.к. в результате реакции образуется многокомпонентная смесь, которую крайне трудно разделить.
Зависимость направления реакции SEAr от природы заместителя в нафталине заметно сложнее, чем в бензоле. Если дизамещенные бензолы существуют в виде трех изомеров, то нафталиновом ряду – 14 изомерных дипроизводных. Входящая группировка может оказаться в кольце или уже имеющем заместитель или в свободном.
На основе знаний о механизме реакции ароматического электрофильного замещения и строении нафталина можно сформулировать два основных правила:
· активирующие группы направляют входящий электрофил в свое кольцо. Если донорная группировка находится в положении 1, второй заместитель входит в положение 4. Если активирующая группа находится в положении 2, второй заместитель входит в положение 1.
· дезактивирующая группа направляет входящий заместитель в a-положении другого кольца при нитровании и галогенировании. В реакции сульфирования направление замещения зависит от температуры и проходит в положения a- или b-свободного цикла.
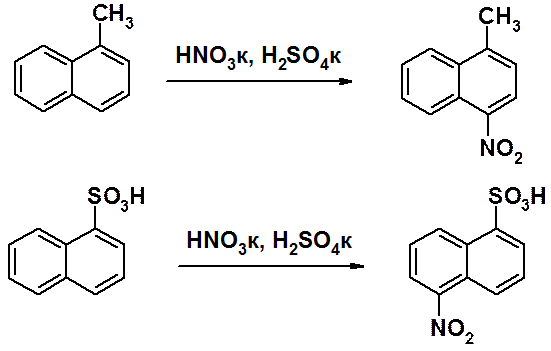
Антрацен и фенантрен трициклические конденсированные ароматические углеводороды. Антрацен относится к линеарным, фенантрен – к ангулярным полициклам.
Энергия делокализации антрацена – 84 ккал/моль (351,7 кДж/моль), фенантрена – 92 ккал/моль (385,1 кДж/моль).
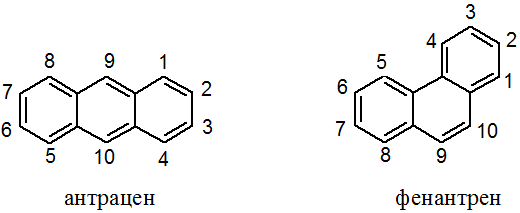
Оба соединения не столь ароматичны как бензол. Ароматичность фенантрена сравнима с нафталином, антрацен менее ароматичен, чем нафталин. Они легко вступают в реакции окисления и восстановления с частичным нарушением ароматической системы. Все реакции (присоединения и замещения) идут в основном по положениям 9 и 10.
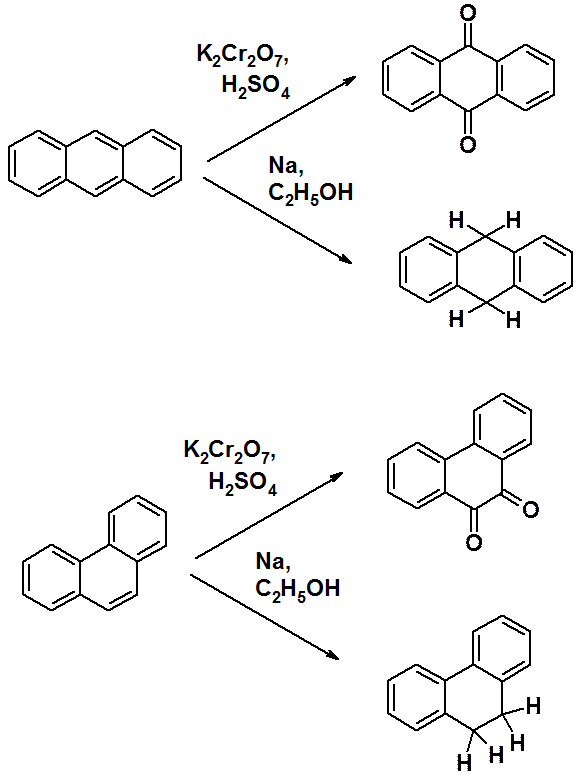
Легко объяснить протекание реакции именно по положениям 9 и 10 трициклических систем. Как видно из схемы, в результате превращений образуются молекулы, имеющие по два изолированных бензольных цикла. Их энергию сопряжения несложно рассчитать: 36 х 2 = 72 ккал/моль. Если предположить возможность протекания восстановления или окисления в боковое кольцо, то в результате образуется бициклическая конденсированная ароматическая система, т.е. нафталин. Его энергия сопряжения 64 ккал/моль, что меньше, чем в рассмотренном выше варианте.
В антрацене реакции бромирования и нитрования протекают через устойчивый продукт присоединения, который ароматизуется только при нагревании.
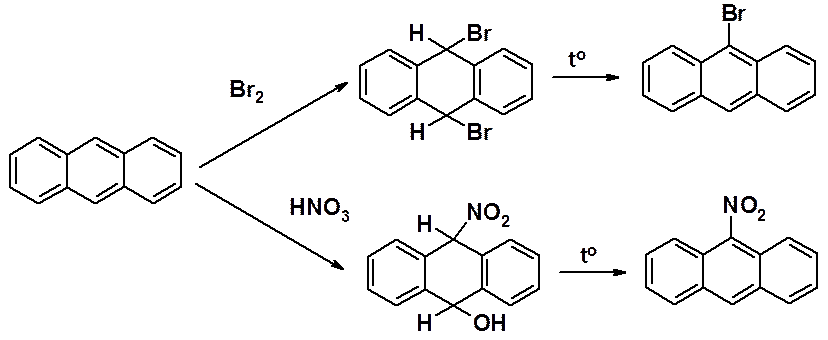
Сульфирование в мягких условиях приводит к 50% смеси 1- и 2-сульфокислот. При повышении температуры образуются ди- и полизамещенные производные.
Бромирование фенантрена приводит к довольно устойчивому продукт присоединения, который при нагреве отщепляет HBr, превращаясь в 9-бромфенантрен.
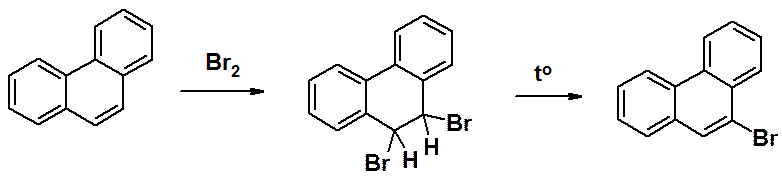
Другие реакции SEAr приводят к сложным смесям. В результате нитрования фенантрена образуется 36% 9-, 26% - 1- и 22% - 3-нитропроизводного. Сульфирование дает 13% 9-, 8% - 1-, 18% -2 и 18% - 3-фенентренсульфониевых кислот.
Недостаток электронной плотности метанового углерода компенсируется ароматическими 6p-электронами трех бензольных колец. Иногда говорят, что положительный заряд «размазан» по всей молекуле. Аналогично (с точностью до наоборот) объясняется стабильность трифенилметильного аниона и радикала. Введение в бензольные кольца заместителей способно заметно увеличить стабильность образующихся в ходе реакций трифенилметильных ионов. Как было показано ранее, донорные заместители стабилизируют катионы, акцепторные – анионы. Наличие в орто- и/или пара-положениях бензольных циклов донорных заместителей увеличивает стабильность трифенилметильного катиона, а акцепторных – аниона. Например, три-(пара-диметиламинофенил)хлорметан (кристаллический фиолетовый) в водном растворе полностью диссоциирован на ионы.

Галогенопроизводные со связью С(sp3)-галоген.
· Номенклатура, изомерия. Физические свойства и спектральные характеристики. Методы получения: галогенирование алканов, реакции присоединения к алкенам и алкинам, реакции замещения в спиртах, альдегидах, кетонах и карбоновых кислотах. Характеристика связи углерод-галоген, индукционный эффект атома галогена. Реакционная способность галогенопроизводных в зависимости от природы галогена.
· Химические свойства. Реакции нуклеофильного замещения галогена у насыщенного атома углерода как метод получения спиртов, тиолов, простых эфиров, нитросоединений, аминов, нитрилов, сложных эфиров и др. Два механизма нуклеофильного замещения (SN1 и SN2). Бимолекулярные реакции (SN2): кинетика, стереохимия, обращение конфигурации. Мономолекулярные реакции (SN1): кинетика, стереохимия, рацемизация. Устойчивость и перегруппировки карбокатионов. Зависимость SN1 и SN2 реакций от природы радикала и уходящей группы субстрата, природы нуклеофильного агента и растворителя.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.