11. СОЕДИНЕНИЯ С СОПРЯЖЕННЫМИ Лекция 13
11.1. Нарушение локализации. Бензол.
В рассмотренных ранее молекулах воды, аммиака и метана четко прослеживается локализация связей. Однако, для таких соединений как бензол и его производные, соединений, состоящих из нескольких бензольных колец, для гетероцикличеких соединений, соединений с двойными сопряжёнными связями локализация связей невозможна. Насыщенные углеводороды – относительно инертные соединения, в то время как ненасыщенные и ароматические углеводороды участвуют в довольно большом количестве разнообразных химических реакций. Именно наличие p-электронов в молекулах двух последних классов объясняется их высокая реакционная способность. Теория модели свободных p-электронов описывает системы сопряжённых двойных связей органических молекул исходя из предположения, что s-электроны углеродных атомов, дающие s-связи, образуют “скелет” молекулы определённой геометрической формы. Благодаря своему положительному заряду скелет создаёт потенциал, под действием которого все p-электроны свободно движутся по всей сопряжённой структуре. При этом во всём окружающем скелет пространстве этот потенциал бесконечно велик. То есть решается задача одномерного потенциального ящика, форма и размеры которого соответствуют скелету молекулы.
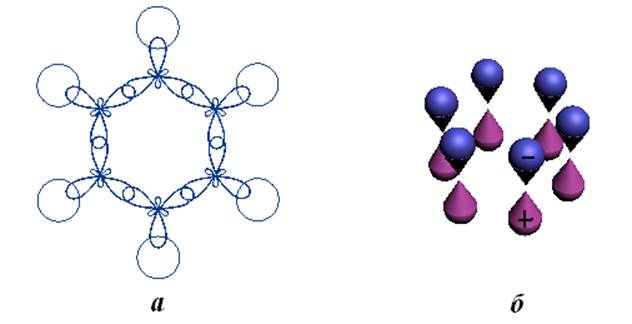
Рис.11.1. Гибридизированные sp2 атомные орбитали углерода с s-атомными орбиталями водорода (а) и pz-атомные орбитали углерода (б) в бензоле.
Рассмотрим молекулу бензола. Как известно (по данным рентгенографии, ИК-спектрометрии), в бензоле атомы углерода располагаются в вершинах правильного шестиугольника. Шесть атомов водорода лежат в той же плоскости в радиальных направлениях. Особенности строения и свойств бензола с успехом были рассмотрены Полингом и Уэландом на основании теории валентных связей и Хюккелем с помощью теории молекулярных орбиталей. В этих методах не учитываются электроны s-связей и молекула бензола рассматривается как шестиэлектронная система.
Сперва рассмотрим молекулу бензола с позиций метода
ВС, который базируется на спаривании электронов. Все валентные углы в бензоле
составляют 120О, что соответствует тригональной гибридизации атомных
орбиталей углерода. В результате образуются локализованные s-связи С-С и С-Н (см. рис.11.1-а).
Оставшиеся 6 электронов атомов углерода (2pz) занимают 6
негибридизированных атомных орбиталей формы гантели (см. рис.11.1-б)
и образуют p-связи. На рис.11.2 представлены варианты спаривания pz-атомных
орбиталей (структуры Кекуле). Оба варианта должны быть включены в волновую
функцию. Молекула бензола ведёт себя так, как будто связи расположены частично
одним способом (а), частично другим (б).
Составление полной волновой функции из двух (и более) взаимно дополняющих структур
называют резонансом (о чём уже говорилось ранее) или “мезомерией”. В этом
случае параметры молекулы лежат где-то между значениями, соответствующими
каждой из структур. Так длина простой связи С-С
1.54 ![]() ,
двойной связи С=С 1.34
,
двойной связи С=С 1.34 ![]() , а в бензоле - 1.40
, а в бензоле - 1.40 ![]() .
.
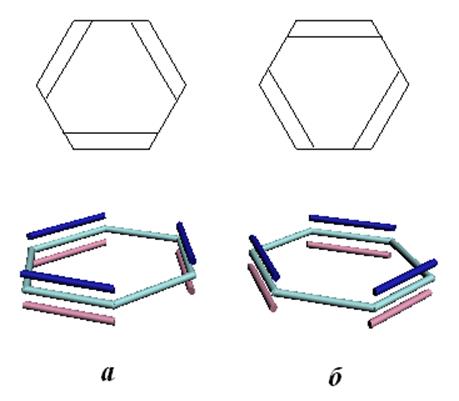
Рис.11.2. Структуры Кекуле.
В рамках метода МО совокупность шести атомных р-орбиталей можно представить в виде линейной комбинации:
Y = с1y1 + с2y2 + . . . + с6y6. (11.1)
В выражении 11.1 константы с1 ... с6 выбираются из условия минимума энергии. Шесть электронов должны занимать МО, простирающиеся в области всех шести атомов углерода. Поэтому они будут полностью делокализованные. Разность энергий такой делокализованной МО и одной из структур Кекуле называется энергией делокализации (это аналог энергии резонанса в методе ВС). Электроны такого типа, которые свободно движутся по циклу, называются подвижными электронами. p-орбитали в молекуле бензола изображены на рис.11.3.
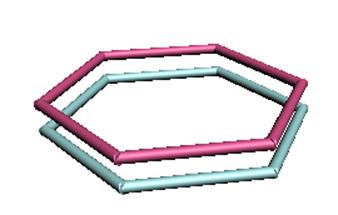
Рис. 11.3. Молекулярные p-орбитали в молекуле бензола (рамы).
Описание состояния шести рz-электронов молекулы бензола требует полной делокализации. Если в методе ВС она является следствием суперпозиции структур (Кекуле и других), то в методе МО происходит обобществление шести pz -орбиталей. Правильность рассмотренной модели молекулы бензола подтверждается следующими фактами:
1) Все связи С-С в бензоле одинаковой длины.
2) Электронные переходы подвижных электронов могут быть рассчитаны и результаты этих расчётов имеют удовлетворительное согласие с экспериментом.
3) В присутствии магнитного поля регистрируется большой диамагнитный эффект, обусловленный электрическими токами (в кольце).
4) Подвижность p-электронов обуславливает лёгкую передачу электрических воздействий по всему кольцу. Так наличие заместителя оказывает влияние на то, в каком месте происходит второе замещение.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.