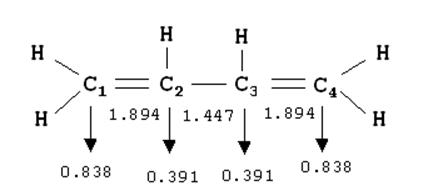
Идея о дробном порядке связи оказалась полезной не только для предсказания длин связей, но и для квантово-механического варианта теории парциальных валентностей. Например, для бутадиена атом углерода С1 участвует в образовании двух связей С-Н, для которых порядок равен 1, и одной С-С, для которой порядок 1.894. Поэтому полный порядок валентности для углеродов № 1 и 2 составит (по методу МО):
N1 = 1.0 + 1.0 + 1.894 = 3.894;
N2 = 1.0 + 1.894 + 1.447 = 4.341. (11.15)
Для атома углерода наибольшее значение N по методу МО равно
![]() . (11.16)
. (11.16)
Свободная
валентность есть разность между максимальным и конкретным значениями
валентности для какого-либо атома, т.е. ![]() . Атом С2 участвует в связывании
больше, чем С1, и
поэтому обладает меньшей свободной валентностью F2 = 0.391.
Для атома С1 F1 = 0.838. Величину Fi
называют также парциальной валентностью Тиле или остаточным сродством
Вернера. При вычислении порядка связи по методу МО оказывается, что для свободных
радикалов Fi > 1, у концевых атомов
углерода в цепи Fi » 0.8, у атомов
углерода в ароматических соединениях Fi » 0.4 (для бензола Fi = 0.40). Очень малые значения Fi
у внутренних атомов конденсированных молекул (насыщенных углеводородов).
. Атом С2 участвует в связывании
больше, чем С1, и
поэтому обладает меньшей свободной валентностью F2 = 0.391.
Для атома С1 F1 = 0.838. Величину Fi
называют также парциальной валентностью Тиле или остаточным сродством
Вернера. При вычислении порядка связи по методу МО оказывается, что для свободных
радикалов Fi > 1, у концевых атомов
углерода в цепи Fi » 0.8, у атомов
углерода в ароматических соединениях Fi » 0.4 (для бензола Fi = 0.40). Очень малые значения Fi
у внутренних атомов конденсированных молекул (насыщенных углеводородов).
По методу ВС получается также дробный порядок связи (в молекуле бензола кратность связи 1.46). Однако значения иные. Так для атома углерода Nmax = 4 и для молекулы бензола соответственно Fi = 0.08. Абсолютные значения свободных валентностей при расчётах по методу МО или ВС могут существенно различаться, но относительные значения совпадают.
11.9. Молекулярные диаграммы.
Численные значения всех основных параметров, характеризующих сопряжённые и ароматические молекулы, удобно представить в виде молекулярной диаграммы (см. табл.11.2).
Таблица 11.2. Молекулярные диаграммы для бензола, нафталина и анилина.
|
вещество |
молекулярные диаграммы |
|
|
по мтоду ВС |
по методу МО |
|
|
бензол |
|
|
|
нафталин |
|
|
|
анилин |
|
|
Из молекулярных диаграмм можно получить следующую информацию:
1. Распределение заряда по молекуле.
2. Направленность диполя (зная распределение зарядов на атомах).
3. Место реакции катиона NO2+ (на атомах с наибольшим отрицательным зарядом) и аниона NH2- (на атомах с наименьшим отрицательным зарядом).
4. Степень делокализации связей.
5. Длину связей (из порядка связи).
6. Место галоидирования (на двойной связи - кратность связи 2 - или ближайшей).
7. Место взаимодействия с радикалом (атомы с наибольшими свободными валентностями).
Следует отметить, что применение к сопряжённым и ароматическим молекулам методов ВС (учёт ионных структур) и МО (учёт взаимодействия конфигураций) приводит к удивительно согласующимся результатам и по энергии резонанса (энергии делокализации), и по длинам связи, и по распределению зарядов.
Общие квантово-механические оценки (расчёты), аналогичные сделанные нами выше, позволяют исследовать многие проблемы органической химии, классифицировать их, установить соответствующую взаимосвязь, дают возможность качественно исследовать интересующие проблемы. В целом приближения ВС и МО удовлетворительны в одинаковой степени. Никакое теоретическое положение нельзя считать доказанным, если оно не вытекает из обоих рассмотренных приближений.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.