Что приводит к энергии резонанса равной:
Е3 - ЕКек = (2.6 - 1.5)А = 1.1А . (11.10)
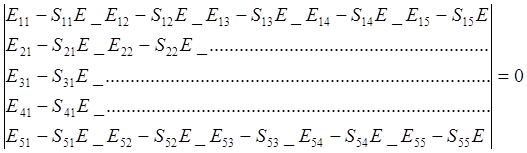
Так как молекула бензола симметрична, то коэффициенты с1 = с2, а с3 = с4 = с5 и волновую функцию можно записать в виде:
Y = с2(ya + yб) + с3 (yв+ yг + yд). (11.11)
Произведя соответствующие вычисления можно получить, что отношение коэффициентов с3 : с2 = 0.4341. Отсюда отношение весов одной структуры Дьюара к весу одной структуры Кекуле (0.4341)2 : 12 = 0.188 : 1. Т.о. можно приписать каждой структуре Кекуле вес 39 %, а каждой структуре Дьюара вес 7,33 %.
Результаты расчёта как для циклических, так и для линейных углеводородов приведены в табл.11.1. Видно, что энергия резонанса больше для циклических молекул. Это связано с тем, что линейным молекулам отвечает только одна структура Кекуле. Циклическим соединениям отвечают несколько структур Кекуле, которые в силу равенства их энергий интенсивно взаимодействуют. Энергия резонанса при этом приблизительно пропорциональна числу замкнутых циклов.
Таблица 11.1. Энергии резонанса (делокализации) для некоторых углеводородов.
|
Соединение |
Энергия делокализации по методу ВС, в интегралах А и эВ |
Энергия делокализации по методу МО, в интегралах b и эВ |
Экспериментальные значения, эВ |
|
бензол |
1.1А 1.76 |
2.00b 1.74 |
1.6 |
|
нафталин |
2.04А 3.26 |
3.68b 3.20 |
3.25 |
|
антрацен |
2.95А 4.72 |
5.32b 4.63 |
4.55 |
|
фенантрен |
3.02А 4.83 |
5.45b 4.74 |
4.77 |
|
дифенил |
2.37А 3.79 |
4.38b 3.81 |
3.42 |
|
бутадиен |
0.23А 0.37 |
0.48b 0.40 |
0.15 |
|
гексатриен |
0.48А 0.77 |
0.99b 0.86 |
0.31 |
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (Примечание к табл.11.1.Бензол - , нафталин
- , антрацен -
(Примечание к табл.11.1.Бензол - , нафталин
- , антрацен - ![]()
![]()
![]()
![]() , фенантрен -
, фенантрен -
![]()
![]()
![]()
![]() , дифенил
- , бутадиен - СН2 =СН-СН=СН2,
гексатриен -
, дифенил
- , бутадиен - СН2 =СН-СН=СН2,
гексатриен -
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
СН2=СН-СН=СН2-СН=СН . Экспериментальные значения энергии резонанса
есть разница между полной теплотой образования молекулы и энергией одной структуры Кекуле. Энергия структуры Кекуле считается в приближении аддитивности энергии связей.)
11.4. Описание бензола с помощью метода МО.
При использовании метода МО предполагается, что
каждый из шести p-электронов движется в
поле, создаваемом ядрами, s-электронами
и остальными (пятью) p-электронами.
Можно рассматривать каждый электрон в отдельности, вводя для этого эффективный
гамильтониан ![]() . Но записать
. Но записать ![]() в явном виде трудно. Поэтому
предпочтительнее найти из эксперимента величины, зависящие от
в явном виде трудно. Поэтому
предпочтительнее найти из эксперимента величины, зависящие от ![]() . Следовательно, конечное значение
энергии имеет эмпирический характер (как и в методе ВС). В результате
вычислений получают уравнение шестой степени, при решении которого находят
следующие корни (ЕО - начало отсчёта, равное энергии 2р-электрона
атома углерода, т.е. соответствует энергетическому состоянию одной из структур
Кекуле):
. Следовательно, конечное значение
энергии имеет эмпирический характер (как и в методе ВС). В результате
вычислений получают уравнение шестой степени, при решении которого находят
следующие корни (ЕО - начало отсчёта, равное энергии 2р-электрона
атома углерода, т.е. соответствует энергетическому состоянию одной из структур
Кекуле):
ЕО + 2b; ЕО + b(двойной корень); ЕО - b (двойной); ЕО - 2b.
Т.к. b отрицательно (-0.87 эВ), то энергия растёт слева-направо. Наиболее низкая МО ЕО + 2b вмещает 2 электрона; следующая - ЕО + b - 4 электрона. Эти орбитали называют связывающими, т.к. Е < ЕО. Остальные - разрыхляющие. Высокая энергия делокализаци в бензоле объясняется тем, что на молекулярной орбитали находятся ровно 6 p-электронов, которые располагаются на связывающих орбиталях. Т.о. полная энергия p-электронов в этом простом приближении составляет:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.