Y = с1y1 + с2y2 + . . . + сnyn, (11.14)
помня,
что Y - плотность вероятности, можно приписать атомам 1, 2,
. . . n электронные заряды с12, с22
, . . . сn2. Благодаря условию нормировки ![]() = 1 учитывается, что полный заряд по всем
атомам цикла равен единице. На рис.11.7 представлены результаты подобных
расчётов для пиридина, хинолина и акридина.
= 1 учитывается, что полный заряд по всем
атомам цикла равен единице. На рис.11.7 представлены результаты подобных
расчётов для пиридина, хинолина и акридина.
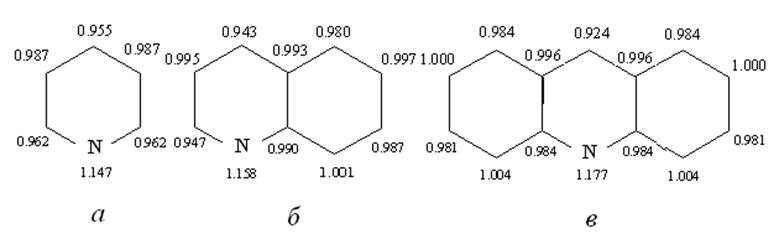
Рис.11.7 распределение заряда на атомах углерода в молекулах пиридина (а), хинолина (б) и акридина (в).
11.6. Дробный порядок связи.
При учёте резонанса между структурами Кекуле и Дьюара все 6 связей в бензоле оказываются эквивалентными и имеют длину, промежуточную между простой и двойной. В связи с этим такой связи приходится приписывать дробный порядок.
В методе ВС значение такой связи можно найти из известных весов каждой из учитываемых структур. Как указывалось в п.11.3, веса структур Кекуле и Дьюара равны соответственно 39 и 7.33 %. Поэтому степень второй связи в молекуле бензола составит 39 + 7.33 = 46.33 (%). Отсюда полный порядок связи 1.46. Молекуле нафталина отвечает 42 ковалентные структуры (ионных членов с заметным весом нет), однако веса их неодинаковы. Поэтому и порядок связей не одинаков. На рис. 11.8 представлены соответствующие данные.
![]() 1.26 1.59
1.26 1.59
![]()
![]()
![]()
![]() 1.43 1.31
1.43 1.31
Рис. 11.8. Порядок связей в молекуле нафталина по методу ВС.
Одно из важнейших применений понятия о порядке связей заключается в предсказании длин связей. По зависимости кратность связи - длина связи, представленной на рис. 11.9, зная кратность, можно определить длину связи и наоборот. И второе: по различию (совпадению) кратности связи можно судить о степени делокализации молекулярной орбитали.
11.7. Метод МО.
В этом методе считается, что подвижный электрон занимает орбиталь, охватывающую несколько ядер, поэтому он участвует во всех связях ароматической системы. Для произвольной связи полный порядок связи должен быть равен сумме вкладов каждой из занятых молекулярных орбиталей. В случае бензола метод МО даёт полный порядок связи 1.67. Т.е. каждый p-электрон участвует в каждой связи на 67 %. Т.к. в бензоле всего 6 рz-электронов, то они, спариваясь, должны давать 3 связи. Суммарное участие p-электронов даёт значение 0.67´6 = 4, которое выше числа 3. Следовательно, метод МО переоценивает электронное спаривание. В то же время метод ВС не дооценивает электронное спаривание, так как 0.46´6 = 2.76 < 3.
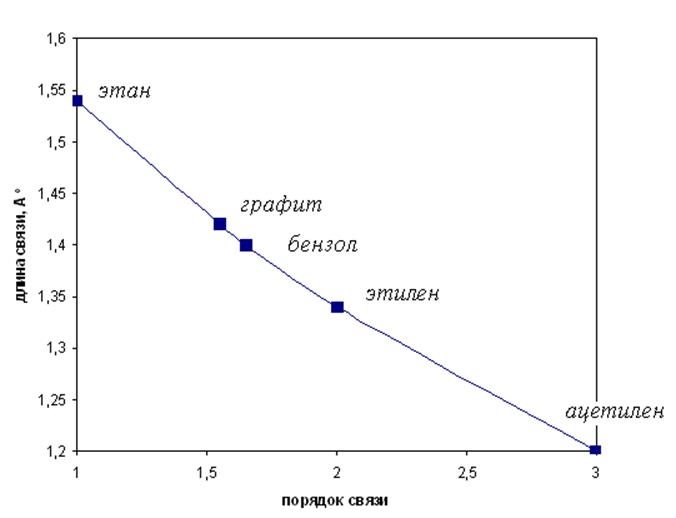
Рис.11.9. Зависимость длины связи С-С от её порядка (метод МО).
Вклады различных молекулярных орбиталей могут быть как положительными, так и отрицательными. Это особенно важно при расчётах молекул в возбуждённом состоянии. При этом можно говорить о том, какие связи при возбуждении будут усиливаться, а какие ослабляться. В качестве примера рассмотрим как изменяется порядок связи в зависимости от состояния в молекуле бутадиена.
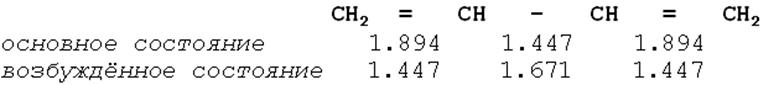
Видно, что в основном состоянии в бутадиене акцепторные свойства проявляет центральная связь. В первом возбуждённом состоянии концевые связи ослабляются, а центральная усиливается.
Способы определения порядка связи в методах ВС и МО не идентичны и поэтому соответствующие зависимости длина связи - порядок связи (рис.11.9) не вполне совпадают. Но во всех случаях значения длин связей, найденные при помощи этих методов, совпадают между собой с точностью любого метода.
11.8. Свободная валентность.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.