6. ТЕОРИЯ ХИМИЧЕСКОЙ СВЯЗИ.
ГОМЕОПОЛЯРНАЯ СВЯЗЬ
В настоящее время принято выделять 4 типа химической связи:
- гомеополярная (ковалентная);
- гетерогенная (ионная);
- металлическая;
- силы Ван-дер-Ваальса.
Химическую связь обычно определяют как взаимодействие двух или нескольких атомов, приводящее к образованию химически устойчивой многоатомной системы. При этом принципиальным является то, что образование химической связи сопровождается перестройкой электронных оболочек. До открытия квантовой химии химическая связь была для химиков и физиков “величайшей загадкой”. С точки зрения классической физики силы связи (гравитационные, электростатические, магнитные) должны быть весьма невелики. Исходя из кулоновского взаимодействия, энергия связи молекулы водорода (Н2) получается равной » 1/20 от реальной величины (0.25 эВ вместо 4.75 эВ). Исходя из законов электростатики, более-менее понятна ионная связь. Силы Ван-дер-Ваальса очень малы и не ведут к образованию молекул. Эти силы играют заметную роль при удержании молекул в конденсированном состоянии. На основе классических представлений нельзя понять почему два нейтральных атома вступают во взаимодействие и образуют молекулу. Невозможно объяснить насыщение валентности или почему один и то же элемент может иметь различную валентность.
Любая предлагаемая теория химической связи должна отвечать на ряд принципиальных вопросов и удовлетворять некоторым требованиям:
1) Почему атомы вступают во взаимодействие.
2) Почему атомы соединяются в определенных соотношениях (валентность).
3) Давать возможность рассчитывать длину и энергию связи, углы между связями.
4) Предсказывать реакционную способность атомов и молекул.
В настоящее время предложены два подхода к объяснению гомеополярной связи. Первый из них – метод валентных связей (иногда называют валентных схем - ВС) или электронных пар – в 1927 г. выдвинули Гайтлер и Лондон. Они предположили, что электроны связи в молекуле находятся на орбитах атомов, входящих в молекулу. Образование связи происходит за счёт перекрытия электронных оболочек разных атомов. При этом их атомные орбитали почти не изменяются. Второй метод - метод молекулярных орбиталей (МО) - в основе своей имеет иной подход: при образовании связи электроны связи теряют своё родство, уходят с исходной атомной орбитали и образуют молекулярные орбитали вокруг объединённых ядер.
6.1. Молекула водорода по методу валентных связей (теория возмущений).
Молекула водорода образуется из двух атомов, находящихся в основном состоянии, с расстоянием между ядрами R. В первом приближении полная энергия молекулы водорода будет равна сумме внутренних энергий отдельных атомов (13.6´2 = 27.2 эВ). Однако за счет взаимодействия атомов между собой полная энергия молекулы Н2 будет иная. Учесть это взаимодействие при расчёте энергии молекулы можно разными способами.
Первый способ, предложенный Ч. Коулсоном – это вычисление полной энергии системы. В этом случае волновое уравнение для системы с двумя электронами будет выглядеть следующим образом:
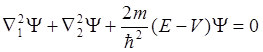 ,
(6.1)
,
(6.1)
где Y - волновая функция двух электронов в молекуле Н2; а
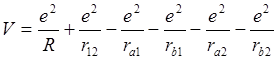 (6.2)
(6.2)
– потенциальная энергия взаимодействия зарядов.
|
r12
r1a r1b r2a r2b
a R b |
Рис. 6.1. Схема молекулы водорода.
Второй способ, предложенный Гайтлером – это расчет только энергии взаимодействия между собой атомов водорода (энергия возмущения).
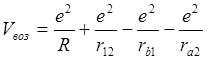 .
(6.3)
.
(6.3)
Энергия взаимодействия между атомами водорода будет зависеть от расстояния между ними. При больших расстояниях Е(R) стремиться к нулю, при малых резко возрастают силы отталкивания (положительные значения Е(R)) и лишь при некотором оптимальном расстоянии наблюдается отрицательное минимальное значение Е(R), которое соответствует равновесному состоянию. Перед нами стоит задача найти энергию взаимодействия для такого состояния молекулы водорода.
Согласно принципам теории возмущений надо взять невозмущенную волновую функцию системы. Состояние электрона первого атома водорода, центр которого расположен в точке “а” описывается ВФ (пренебрегая нормировочным множителем):
![]() .
(6.4)
.
(6.4)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.