Свойства химической связи и валентности получают из простых качественных рассуждений, основанных на характере взаимодействия валентных электронов двух атомов. Рассмотрим, к примеру, возможное взаимодействие атомов водорода и гелия. В основном состоянии атом Не имеет два электрона, которые находятся на нижнем энергетическом s-состоянии и спины их антипараллельны. При приближении к атому Не атома Н может возникнуть только один тип взаимодействия – обменное. Предположим, что электрон водорода со спином попытается обмениваться с электроном Не со спином ¯. В этом случае из трёх электронов вблизи с атомом Не два будут параллельны (), что запрещено принципом исключения Паули. Поэтому атомы водорода и гелия не образуют молекулы. Такие рассуждения можно распространить на все инертные газы. Эти элементы состоят из полностью заполненных электронных оболочек, все электроны которых находятся в спаренном состоянии с антипараллельными спинами. По этим же причинам молекула водорода Н2 не будет взаимодействовать с атомом водорода Н. В Н2 наступает насыщение связи.
Отталкивание заполненных оболочек играет свою роль и в ионной связи. Например, ионы Na+ и Cl- имеют внешние оболочки как у благородных газов. Уже на больших расстояниях они начинают притягиваться друг к другу по закону Кулона, т.к. электрические силы имеют значительно больший радиус воздействия, чем обменные. Но на близких расстояниях силы отталкивания обменных параллельных спинов начинают превышать силы электростатические. Равенство упомянутых сил определяет радиусы ионов.
Молекулы образуются из двух атомов только в том случае, если каждый из атомов имеет электрон со свободным спином (для того, чтобы могла образоваться пара с антипараллельными спинами). Теоретически это выражается в том, что мы выбираем две атомные орбитали ya и yb, относящиеся к разным атомам, и составляем полную волновую функцию следующего вида:
![]() (6.30)
(6.30)
Этот процесс часто называют спариванием электронов (спинов), а метод валентных связей - методом электронных пар. Связывание имеет место только в том случае, когда спины антипараллельны. Образование ковалентной химической связи возможно только тогда, когда в исходных атомах имеются неспаренные электроны. Помимо этого необходимого условия должны выполняться и другие, на которые указывает принцип максимального перекрывания. Этот принцип включает в себя следующие положения:
- энергии (собственные значения гамильтанианов) для волновых функций ya и yb атомов должны быть сравнимы по величине;
-
зарядовые облака еya2 и еyb2 должны
по возможности полнее перекрываться; интеграл перекрывания ![]() Ya×Ybdt служит
приближённой мерой прочности связи.
Ya×Ybdt служит
приближённой мерой прочности связи.
- ya и yb должны обладать одинаковыми свойствами симметрии относительно оси молекулы.
Рассмотрим несколько примеров.
1. В молекуле Li связь обусловлена спариванием двух 2s-электронов с образованием s-связи. Здесь всё просто.
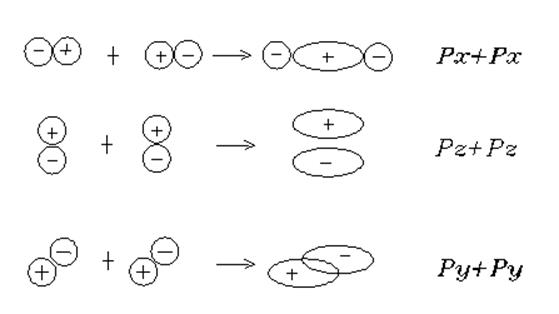
2. В молекуле N2 связь тройная NºN поскольку азот имеет электронную конфигурацию 1s22s22px2py2pz.. Здесь возможно спаривание двух 2px-электронов по оси соединения атомов азота с образованием s-связи, а также двух p-связей с участием двух 2py- и двух 2pz-электронов. 2s2-электроны принимать участие в образовании связи не могут, т.к. уже спарены между собой.
3. В молекулах F2 и Cl2 связи простые - имеется единственный неспаренный электрон 2px или 3px (Х - направление вдоль связи). Эти электроны образуют s-связь.
Метод валентных связей даёт довольно хорошее качественное объяснение электронного строения молекул с одинаковыми ядрами. Однако количественных расчётов мало, что связано с рядом трудностей:
- необходимо составить точные волновые функции, которые содержали бы поправки на поляризацию, экранирование, вклад ионной составляющей;
- следует учитывать спаренные электроны внутренних оболочек и валентной оболочки (они могут заметно влиять на энергию связи);
- для точных расчётов мало учитывать только оптимальные варианты спаривания электронов (принцип максимального перекрытия). Надо рассмотреть все возможные варианты, образуя из них линейную комбинацию.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.