![]() .
(6.25)
.
(6.25)
С учётом ковалентной составляющей общая волновая функция будет выглядеть следующим образом:
Y = Yков + С×Yион. (6.26)
Коэффициент С можно определить вариационным методом из условия минимума энергии системы. Он оказался равным 0.25. С учётом экранировки, поляризации и ионного состояния энергия связи приближается ещё ближе к экспериментальному значения и равна 4.10 эВ.
6.3 Молекула водорода (вариационный метод).
Рассмотрим молекулу водорода с позиций вариационного метода на примере волновой функции, состоящей из двух слагаемых:
![]() .
.
Соответствующая ей энергетическая функция такова:
Е = 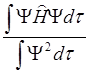 =
=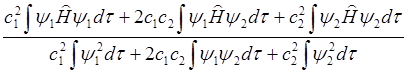 . (6.27)
. (6.27)
Введём следующие обозначения:
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
Причём
очевидно, что Е12 = Е21 и S12
= S21. Кроме того, если y1 и y2 нормированы, то S11 = S22
= 1. Величина Е12 называется недиагональным матричным
элементом гамильтониана ![]() относительно функций
y1 и y2, а S12
называют интегралом перекрывания или интегралом
неортогональности.
относительно функций
y1 и y2, а S12
называют интегралом перекрывания или интегралом
неортогональности.
Используя принятые обозначения, запишем выражение 6.27 в следующем виде:
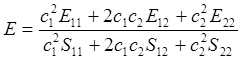 (6.28)
(6.28)
Для отыскания коэффициентов с1 и с2, согласно вариационному принципу, минимизируем энергетическую функцию Е. Т.е. возьмём частные производные Е по с1 и с2 и приравняем их нулю:
![]() dE/dc1 = 0 и dE/dc2 = 0.
dE/dc1 = 0 и dE/dc2 = 0.
В результате этого получаем так называемые секулярные (или вековые) уравнения:
![]() ;
;
![]()
Или при обозначении Е1 = Е11, Е2 = Е22 и, учитывая, что ВФ нормированы:
![]() ;
(6.29)
;
(6.29)
![]() .
.
Если из них исключить соотношение с1/c2, то получим:
(Е - Е1)(Е - Е2) - (Е12 - Е S12)2 = 0.
Корни этого уравнения дают минимальное и максимальное значение энергии системы при равновесном расстоянии между атомами. Эти значения соответствуют основному и возбуждённому состояниям системы. Рассмотрим изменение f(E) при разных значениях Е, где f(E) = (Е - Е1)(Е - Е2) - (Н12 - Е S12)2.
Вид зависимости f(E) представлен на рис.6.4.
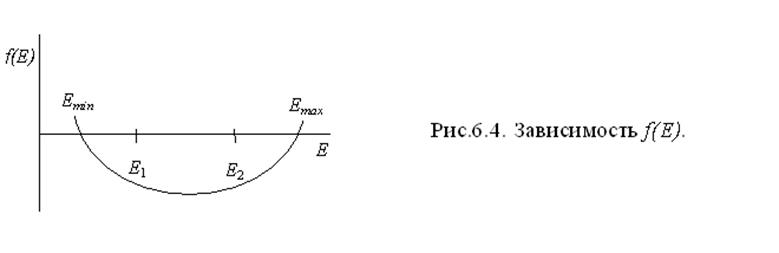 Видно, что f(E)
= 0 при значениях Еmin < Е1
и Еmax > Е2 . Т.е. для линейной комбинации
двух волновых функций получаются два уровня энергии, один из которых (основной)
ниже, а другой (возбуждённый) выше первоначальных Е1 и Е2.
Картина получается такой, как если бы два первоначальных уровня Е1
и Е2 отталкивались один от другого. При этом такая картина
наблюдается не только при равновесном расстоянии между атомами водорода, но и
при других значениях R. Даже в том случае, когда кривые Е1(R)
и Е2(R) пересекаются, кривые, вычисленные для функции Y = y1 + y2 (Еmin
и Еmax), никогда не пересекаются. Данное правило, которое
справедливо и для комбинации из большего, чем две волновые функции, называется
правило непересечения. Правило непересечения было установлено
Ландау Л. Д. и Зенером К. в 1932-33 гг. На рис.6.5 данное правило представлено
графически. Состояния Еmin (основное состояние) и Еmax
(возбуждённое состояние) важны, поскольку электронные переходы между ними
ответственны за одну из характеристических полос поглощения.
Видно, что f(E)
= 0 при значениях Еmin < Е1
и Еmax > Е2 . Т.е. для линейной комбинации
двух волновых функций получаются два уровня энергии, один из которых (основной)
ниже, а другой (возбуждённый) выше первоначальных Е1 и Е2.
Картина получается такой, как если бы два первоначальных уровня Е1
и Е2 отталкивались один от другого. При этом такая картина
наблюдается не только при равновесном расстоянии между атомами водорода, но и
при других значениях R. Даже в том случае, когда кривые Е1(R)
и Е2(R) пересекаются, кривые, вычисленные для функции Y = y1 + y2 (Еmin
и Еmax), никогда не пересекаются. Данное правило, которое
справедливо и для комбинации из большего, чем две волновые функции, называется
правило непересечения. Правило непересечения было установлено
Ландау Л. Д. и Зенером К. в 1932-33 гг. На рис.6.5 данное правило представлено
графически. Состояния Еmin (основное состояние) и Еmax
(возбуждённое состояние) важны, поскольку электронные переходы между ними
ответственны за одну из характеристических полос поглощения.
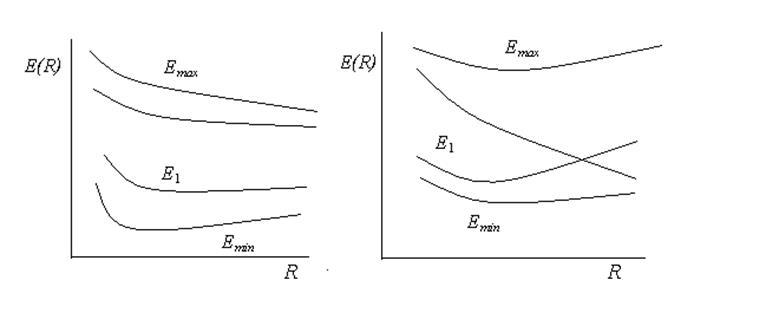
Рис.6.5. Зависимость Е1, Е2, Еmin и Еmax от R.
Следует отметить, однако, что правило непересечения справедливо только тогда, когда волновые функции y1 и y2 одной симметрии. Потенциальные кривые для волновых функций разной симметрии могут пересекаться.
6.4. Условия образования химической связи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.