где
dx/dt = W – скорость образования кислорода, ![]() – число
молей О2, которое можно получить при полном разложении a
молей H2O2.
– число
молей О2, которое можно получить при полном разложении a
молей H2O2.
Поскольку при фиксированной температуре и постоянном давлении величина x пропорциональна объёму выделившегося O2,
![]()
или, после интегрирования,
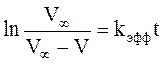 . (3)
. (3)
Полный
объём кислорода, ![]() , вычисляется по формуле:
, вычисляется по формуле:
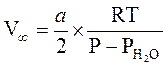 ,
,
где P - атмосферное давление по барометру, PH2O - давление насыщенного пара воды при температуре Tкомн.
Данные каждого кинетического опыта заносят в отдельную таблицу (табл. 2), в заголовке которой указывают все условия опыта, концентрации компонентов, pH раствора, значение V¥.
Таблица 2
Результаты кинетического опыта.
|
t, мин |
V, мл |
|
|
По данным каждого опыта строят график «ln{V¥ /(V¥ -V)} – t» и вычисляют значения kэфф.
Для опытов № 1–3 строят зависимость ln(![]() )нач от ln[H2O2]нач
и определяют порядок реакции по Н2О2.
)нач от ln[H2O2]нач
и определяют порядок реакции по Н2О2.
Зависит ли kэфф (в пределах ошибки эксперимента) от [Н2О2]? Верно ли предположение о первом порядке реакции (2) по Н2О2?
Из данных опытов №№ 1, 4–8 определяют порядки реакции по Fe2+ и H+.
Используя данные опытов №№ 1, 9 и 10 строят график в аррениусовских координатах и находят энергию активации реакции.
Литература
1. У.Шамб, Ч.Сеттерфилд, Р.Вентворс. Перекись водорода. М.: ИЛ, 1958.
2. А.Я.Сычев, В.Г.Исак. Гомогенный катализ соединениями железа. Кишинев: Штиинца, 1988.
Задача К-9
ИЗУЧЕНИЕ РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ
ПЕРСУЛЬФАТ-ИОНОВ С ИОДИД-ИОНАМИ
К-9.1. Определение энергии активации реакции взаимодействия персульфат-ионов с иодид-ионами
Цель работы
Целью работы является определение энергии активации из измерений температурной зависимости скорости реакции без регистрации кинетической кривой (зависимости концентрации реагентов от времени). Используемый метод позволяет визуально фиксировать достижение заданной степени превращения по изменению окраски раствора.
В работе исследуется реакция персульфата калия (K2S2O8) с иодидом калия (KJ) в водном растворе.
S2O82- + 2J- ¾® J2 + 2SO42- (1)
Температурная зависимость скорости реакции может быть описана уравнением Аррениуса:
K=Ko*exp(–Ea/RT),
где К – наблюдаемая (эффективная, эмпирическая) константа скорости реакции, Ко – предэкспоненциальный множитель, а Еа – наблюдаемая энергия активации, которая, в случае сложной реакции, может зависеть от температуры, что может проявляется при проведении измерений в широкой области температур.
Маловероятно, что данная реакция, является простой, поскольку примеры тримолекуляных реакций редки. Предполагаемый механизм реакции обсуждается ниже. Если механизм содержит лимитирующую стадию, наблюдаемая энергия активации может совпадать с энергией активации лимитирующей стадии. В любом случае определение наблюдаемой энергии активации дает удобную численную характеристику изучаемой реакции.
Для нахождения наблюдаемой энергии активации сложной реакции удобно, вместо определения константы скорости реакции и непосредственного применения уравнения Аррениуса, обрабатывать данные по температурной зависимости скорости реакции при фиксированных концентрациях реагентов.
Пусть W – скорость реакции, х – глубина реакции, a – начальная концентрация S2O82-, b – начальная концентрация J-, n(a) и n(b) – порядки реакции по соответствующим веществам. Тогда
W(T) = K(T) *(a–x)n(a)*(b–2x)n(b)
Ясно, что при фиксированном x и постоянных a и b
W(T) = (const)*K(T)
и
W = (const)*exp(–Ea/RT).
Поэтому энергия активации может быть определена из температурной зависимости скорости реакции.
В соответствие с определением, скорость реакции есть
W = d[J2]/dt.
Если глубина реакции x << a,b, а начальная концентрация молекулярного иода равна нулю, скорость реакции W может быть определена как
W = [J2]/(t–to).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.